熱力系統在某種因素推動下發生狀態變化的過程。熱力過程的特點反映在過程方程上,過程方程描述受特定過程約束的熱力狀態參數間的函數關係,由此可得出系統變化前後的狀態參數關係式。研究熱力過程,就是為瞭導出過程方程或初、終態的狀態參數關係式,以及系統與外界之間功和能量的交換。這些都是熱力學中分析計算熱力過程和熱力迴圈所必需的。對於單位品質的理想氣體,可逆的典型熱力過程有定容過程、定壓過程、定溫過程、絕熱過程和多變過程。
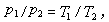 式中
p
1、
p
2、
T
1、
T
2、分別為系統初、終態的壓力和溫度。定容過程在
p-
V圖(見圖)上由垂直線1-2表示。它表明系統對外不作功,向系統輸入的熱量
Q全部轉變成系統內能
U的增加,即
式中
p
1、
p
2、
T
1、
T
2、分別為系統初、終態的壓力和溫度。定容過程在
p-
V圖(見圖)上由垂直線1-2表示。它表明系統對外不作功,向系統輸入的熱量
Q全部轉變成系統內能
U的增加,即
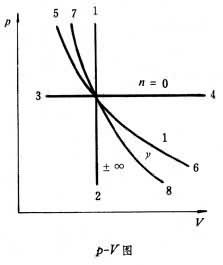
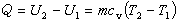 式中
m為系統的質量,
c
v為定容比熱容。
式中
m為系統的質量,
c
v為定容比熱容。
定壓過程 壓力p保持不變的熱力過程,又稱等壓過程。例如在大氣壓力下,氣缸中氣體的受熱膨脹。過程方程為:p=常數,因此V1/V2=T1/T2。它在p-V圖上由水平線3-4表示。這時,系統對外所作的功
W=p(V2-V1)=mR(T2-T1)
外界向系統輸入的熱量
Q=H2-H1=mcp(T2-T1)
式中R為理想氣體的氣體常數,cp為定壓比熱容;H為系統的焓。
定溫過程 溫度T保持不變的過程,又稱等溫過程。例如室溫下緩慢地壓縮氣體的過程。過程方程為:T=常數,因此,p1V1=p2V2。它在p-V圖上由等邊雙曲線5-6表示,過程中向系統輸入的熱量等於系統對外界所作之功
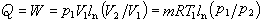
絕熱過程 系統與外界沒有熱量交換的熱力過程。例如氣體在氣缸內的絕熱膨脹。可逆的絕熱過程在過程進行中其熵不變,故又稱定熵過程。過程方程為:pVγ=常數,因此有:
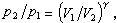 式中
式中
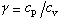 ,稱為絕熱指數或比熱容比,其中
c
v為定容比熱容。絕熱過程在
p-
V圖上表示為高次雙曲線7-8,這時系統對外界所作的功
,稱為絕熱指數或比熱容比,其中
c
v為定容比熱容。絕熱過程在
p-
V圖上表示為高次雙曲線7-8,這時系統對外界所作的功
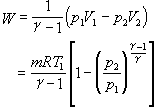
多變過程 符合過程方程pVn=常數,其中多變指數n在過程中保持不變的熱力過程。參數關系式為
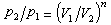 過程中向系統輸入的熱量
過程中向系統輸入的熱量
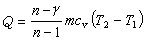 系統對外界所作的功
系統對外界所作的功
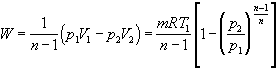 當多變指數
n值分別取0、1、
γ、±∞時,多變過程就相應地成為前面提到的定壓、定溫、絕熱和定容過程。
當多變指數
n值分別取0、1、
γ、±∞時,多變過程就相應地成為前面提到的定壓、定溫、絕熱和定容過程。