如果小離子和溶劑分子都能通過半透膜,在平衡時電解質在膜兩邊的濃度應相同。如果有大分子電解質存在,則它的大離子不能透過半透膜,當這一體系達到滲透平衡後,小離子在膜兩邊的濃度就不相等瞭,這種現象稱為膜平衡。由於這一現象是F.G.唐南發現的,又稱唐南平衡。例如,將濃度為c1的蛋白質鈉鹽(Na+R
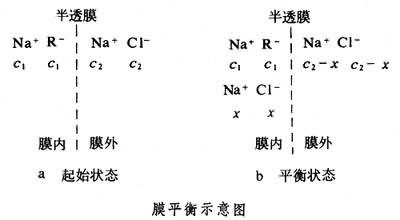 在起始狀態,因為蛋白質大離子
R
-不能擴散到膜外,而
Na
+與
Cl
-等小離子可以通過膜,為瞭保持膜兩邊溶液為電中性,擴散時須滿足膜內外
Na
+交換的數目相等和等量的
Na
+與
Cl
-同時由膜外擴散到膜內的條件。設有濃度為
x的小離子由膜外進入膜內,最後的平衡狀態如圖中 b所示。由熱力學的平衡條件可知,小離子在膜內濃度的乘積等於其膜外濃度的乘積:
在起始狀態,因為蛋白質大離子
R
-不能擴散到膜外,而
Na
+與
Cl
-等小離子可以通過膜,為瞭保持膜兩邊溶液為電中性,擴散時須滿足膜內外
Na
+交換的數目相等和等量的
Na
+與
Cl
-同時由膜外擴散到膜內的條件。設有濃度為
x的小離子由膜外進入膜內,最後的平衡狀態如圖中 b所示。由熱力學的平衡條件可知,小離子在膜內濃度的乘積等於其膜外濃度的乘積:
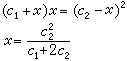
此式表明,進入膜內的氯化鈉濃度x的大小與起始時膜內蛋白質鈉鹽的濃度c1和膜外氯化鈉的濃度c2有關。當c2》c1時,x≈c2/2,表明氯化鈉約有一半進入膜內,即平衡時膜內外氯化鈉濃度大致相等。若c1》c2,x=c22/c1≈0,即氯化鈉幾乎不進入膜內。在生物體內細胞膜是一種半透膜,細胞裡的蛋白質和細胞外的體液即存在膜平衡。膜平衡原理可說明細胞膜的透過性問題。當細胞內蛋白質濃度很小或細胞外電解質濃度很大時(c2》c1),細胞膜對於小離子就顯得完全能通過;當細胞內蛋白質很濃時(c1》c2),小離子幾乎完全通不過細胞膜。此外,膜平衡原理還可以說明滲透細胞膜的同一種離子為何在細胞的內外濃度不相同。例如,若起始時NaR與NaCl的濃度都等於c,則達到膜平衡時膜外的[Na+]為0.67c,[Cl-]為0.67c;膜內的[Na+]為1.33c,[Cl-]為0.33c。
由於小分子電解質的存在對蛋白質溶液的滲透壓有很大的影響,測定滲透壓時必須消除其影響,方能得出正確的結果。膜平衡原理解決瞭蛋白質滲透壓測定的問題。由於膜平衡的作用,膜內蛋白質溶液對膜的滲透壓Π為:
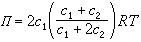
式中R為氣體常數;T為熱力學溫度。這時蛋白質溶液的滲透壓不僅與蛋白質濃度c1有關,而且受膜外電解質濃度c2的影響。若在測定時,使c2c1,則可得:
Π=c1RT
因而蛋白質溶液的滲透壓隻由其濃度決定。