環戊烷多氫菲衍生物,固醇的一種,構成細胞膜及其他生物膜的重要成分,也是體內轉變成皮質固醇類激素、性激素的前體;7-脫氫膽固醇經紫外線照射可轉變為維生素D3,這是曬太陽預防佝僂病的機理。眾所周知,高血漿膽固醇是發生心血管疾病的風險因素,所以膽固醇成為固醇類化合物中最著名的成員。膽固醇在肝臟可轉變為膽汁酸,再經膽道、膽囊排入腸腔;膽汁酸既是膽固醇排泄出體外的形式,也是腸道消化吸收脂類食物物的必要物質。膽固醇既可從食物中攝取,也可在體內合成;肝臟可從乙酸活化物即乙酰輔酶A合成膽固醇並將其運送給其他組織;小腸等其他組織也有合成膽固醇的能力。膽固醇或遊離存在或與脂肪酸結合成酯存在。膽固醇和膽固醇酯以脂蛋白形式運輸,各種脂蛋白所含膽固醇的量不一,以低密度脂蛋白含量最高。生物膜中的膽固醇可以調整膜的流動性以適應不同的功能要求。膽固醇在體內各組織中分佈不一,富含細胞膜的髓鞘含膽固醇量很高,所以腦及神經組織膽固醇最豐富,肝臟、小腸等臟器含量也不少。作為食物,動物的上述臟器組織以及傢禽類卵黃含膽固醇量高。植物不合成膽固醇,不含膽固醇,所以植物食品是無膽固醇的。膽固醇是包括人類在內的所有動物所不可缺少的成分,但是膽固醇代謝異常又與疾病相關。由於尚未瞭解清楚的原因,膽固醇可以大量沉積在動脈管壁上,致管腔狹窄,是為動脈粥樣硬化。膽汁中膽固醇過量或膽固醇與膽汁酸和卵磷脂的比例失調都可形成以膽固醇為主的膽石癥,這多見於飲食過多的肥胖者。
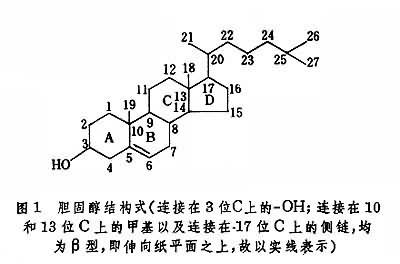
膽固醇的化學結構 膽固醇是由 A、B和C等三個六碳環和一個五碳環D合並而成的環戊烷多氫菲衍生物,共含27個碳原子(圖1)。環間相互以反式連接,通常取穩定的椅式構像。膽固醇除在5及6位碳之間有雙鍵外,其餘的碳多為氫所飽和(故稱“多氫”)。各個碳原子的編號如式上所示,式中按慣例略去氫原子,CH3基也隻以短線表示,如18、19、21、26和27位碳甲基。3位碳上有一個羥基,17位碳上是1條八碳側鏈。環戊烷並菲核心為板狀剛性結構,在其上的一端是具撓性的八碳側鏈,而在其另一端是羥基。
膜中膽固醇 生物膜的基本結構是脂雙層,即主要由磷脂分子構成的兩層結構。磷脂是兩性分子,含有親水的頭部(磷酸根及接連在磷酸根上的膽堿、乙醇胺、絲氨酸或肌醇等基團)和疏水的烴鏈。以細胞膜為例,一層磷脂分子的頭部接觸細胞膜外側水相,它的疏水烴鏈對向另一磷脂分子層的烴鏈,後一分子層磷脂的親水頭部則面向細胞內的水性環境。總之,磷脂的親水頭部處於脂雙層外面,與水相接觸,而其疏水的烴鏈被裹在內。生物膜基本上是具有流動性的脂雙層鑲嵌著各種不同的可流動的蛋白質。膽固醇具有親水性的羥基,具有疏水性的側鏈和其他部分,也是兩性分子。膽固醇具兩性分子特性,參與構成生物膜,並在其中起重要作用。如前所述,生物膜是一種流動鑲嵌結構,生物膜的各種功能與其流動性相關。一些原生生物以改變磷脂中脂肪酸的長度和飽和度來調節流動性以適應溫度等的環境變化。在真核細胞,膽固醇是調節生物膜流動性的重要因素。它以其長軸與膜平面垂直插入脂雙層,其羥基與親水性的磷脂頭部羰基氧原子形成氫鍵,其具有撓性的烴鏈置於脂雙層疏水性核心中。膽固醇若插到磷脂的胞和烴鏈中間就阻礙這些烴鏈相互緊密規則排列,從而增加膜的流動性。膽固醇若插到磷脂的不飽和烴鏈中間卻又可限制瞭這些含雙鏈烴鏈的活動性,從而降低瞭膜的流動性。總之,膽固醇可調節生物膜的流動性至適中的程度。不同生物膜的膽固醇含量不一,細胞膜中含量高,與磷脂的摩爾比可達0.8,線粒體膜中膽固醇含量則甚低。
血漿膽固醇 正常人空腹血漿中總膽固醇含量為1.2~2.2g/L(3.1~5.7mmol/L)。血漿膽固醇含量隨年齡增長而增高,高脂肪膳食可增高血漿膽固醇;女性在停經後血漿膽固醇增高。膽固醇總量中約2/3為膽固醇酯,膽固醇酯極為疏水,存於脂蛋白核心內,而膽固醇可與磷脂和蛋白質構成脂蛋白與水相接觸的表面。血漿中遊離的膽固醇可接受卵磷脂上的β位脂酰基而形成膽固醇酯,催化這個反應的酶稱卵磷酯膽固醇脂酰基轉移酶(LCAT);該酶由肝臟合成,分泌到血漿,而血漿內高密度脂蛋白(HDL)中的載脂蛋白A-I是這個脂酰基轉移酶的激動劑,故酯化反應與 HDL密切相關。肝臟合成的膽固醇以極低密度脂蛋白(VLDL)形式送入血漿,在人類VLDL含的主要是遊離膽固醇,然後由LCAT轉變為膽固醇酯。VLDL經過脂蛋白脂肪酶等作用先後轉變為中間密度脂蛋白 (IDL)和低密度脂蛋白(LDL)。LDL所含載脂蛋白B100與組織中的LDL受體結合而被內吞,這是肝臟供應肝外組織膽固醇的方式。當然LDL或VLDL殘體也可被肝臟回收。HDL也由肝臟分泌,但它可在血循環中從其他脂蛋白及組織中攝取膽固醇,HDL最後也被肝臟回收,但它起的作用卻是從肝外組織攜歸膽固醇。食物中的膽固醇可直接吸收而膽固醇酯則要經胰液中膽固醇酯酶水解後方可吸收。吸收後的膽固醇以及小腸本身合成的膽固醇在小腸與其他脂肪及一些蛋白質構成乳糜微滴,乳糜微滴運行中經脂蛋白脂肪酶等作用後成為乳糜微滴殘體(其原含膽固醇組分損失甚微),與肝細胞載脂蛋白 E受體結合而被吞入;在細胞中膽固醇酯可水解為膽固醇,這是肝臟獲取食物中膽固醇的方式,從食物中來的膽固醇可以抑制肝中合成膽固醇;肝外組織從LDL取得的膽固醇也抑制該組織合成膽固醇。
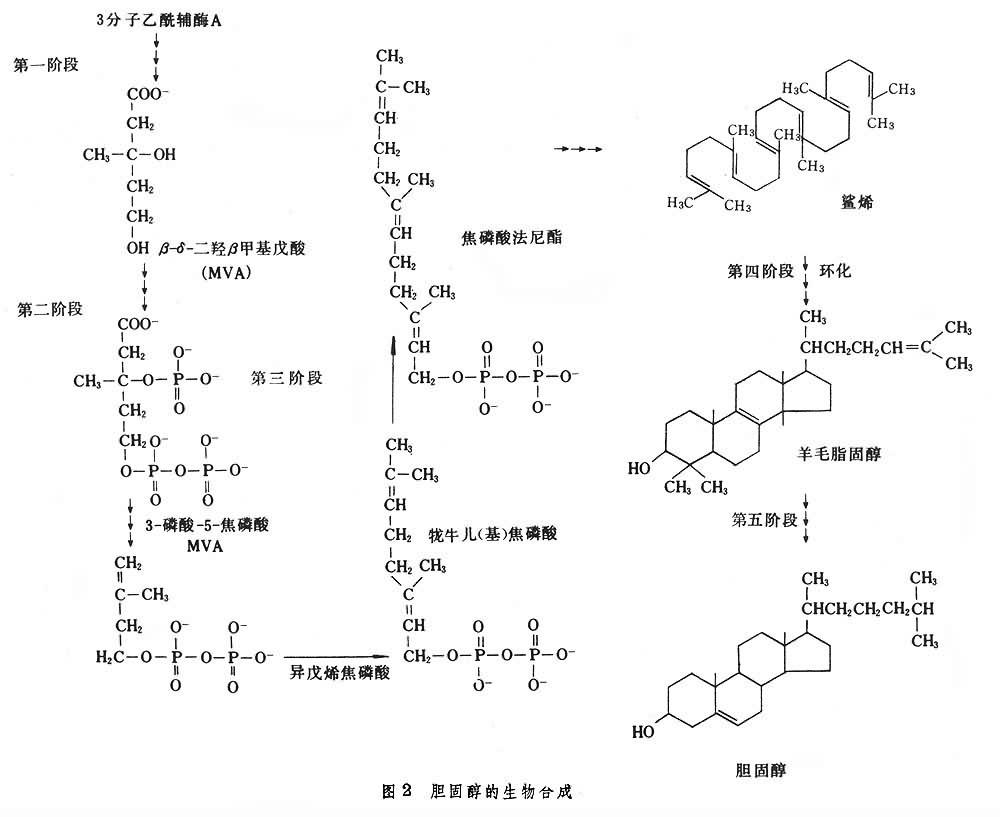
膽固醇的生物合成 膽固醇可在人體多種組織中從頭合成;即以糖、脂肪酸及氨基酸分解代謝中間產物乙酰輔酶A為原料,經過甚復雜的反應步驟合成膽固醇。肝臟是合成膽固醇的主要臟器,小腸合成的也為數不少。膽固醇的合成有30種以上的酶以及其他一些輔助因子參加,這些酶或存在於胞漿或見於內質網。合成過程大致可分為5個階段(圖2)。①2分子乙酰輔酶A縮合成為乙酰乙酰輔酶A,再縮合1分子乙酰輔酶 A而成3-羥基-3-甲基戊二酰單酰輔酶 A(HMG-CoA)。HMG-CoA經還原酶催化還原並脫去輔酶A而成為甲羥戊酸(MVA);HMG-CoA還原酶是調節膽固醇合成的關鍵酶。②6個碳原子的MVA經2次磷酸化後脫去1個羧基成為5個碳原子的異戊烯焦磷酸(IPP);它可轉變成同分異構物3.3-二甲丙烯焦磷酸 (DPP)。③1分子IPP與1分子DPP縮合為10個碳原子的焦磷酸牛兒酯,然後又再縮合1分子IPP而成15個碳原子的焦磷酸法呢酯。兩分子焦磷酸法呢酯縮合成30個碳原子的鯊烯。④鯊烯結合到稱為固醇載體蛋白 (scp)的胞液成分後受鯊烯環氧酶和環化酶催化而成為環化的羊毛固醇;它已是環戊烷並菲化合物,但卻仍含30個碳原子。⑤羊毛固醇經過約20步酶促反應方轉變為27個碳的膽固醇。膽固醇含有很多不對稱碳原子,有很多可能的立體異構體,但膽固醇的立體結構是不變的,可見合成反應之精巧準確無誤。合成1摩爾膽固醇需要18摩爾乙酰輔酶A,消耗36摩爾ATP和16摩爾NADPH,要花費很大能量,所以饑餓等狀態下膽固醇的合成是降低的。膽固醇的生物合成主要通過 HMG-CoA還原酶實現調節。膽固醇雖無直接抑制該酶的活性,但它或它的氧化物阻遏該酶的合成,食物中的膽固醇進入肝臟或者LDL的膽固醇進入肝外組織也都抑制膽固醇合成。此外,HMG-CoA還原酶還受磷酸化-脫磷酸化機制調節;還原酶由於激酶作用磷酸化後就不具活性,經磷酸酶脫去磷酸根後又可重新恢復活性,這種修飾調節比較快,與一些激素引起的cAMP變化相關。體內膽固醇的合成受一定的控制和調節。膽固醇在體內的量超過正常時,則負反饋抑制 HMG-CoA還原酶。膽固醇反饋抑制的另一個作用點是鯊烯環化為羊毛脂固醇這一步。因此有人認為,食入的膽固醇量較多時,會反饋抑制肝內膽固醇的合成。
膽固醇的排泄 膽固醇的固醇核不為人體所降解,但膽固醇可經肝臟從膽汁排入小腸而隨糞便排出體外。膽固醇也可在肝臟降解為24個碳原子的膽汁酸,也同樣經膽汁排出體外。膽汁酸是含3個或2個羥基的類固醇。在人類膽汁中主要是3個羥基的膽酸(圖3)和2個羥基的鵝脫氧膽酸(圖4)。
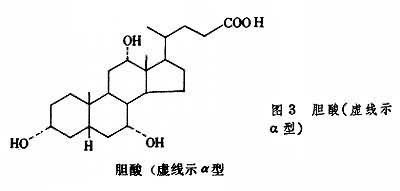
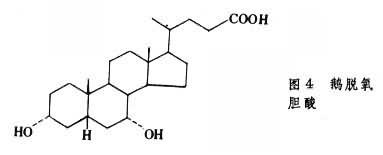
所有的羥基都是α型的,固醇核上有2個β型甲基,這使膽汁酸分子一面具親水性另一面具疏水性,再加上24位碳上有羧酸,因此兩性性質更顯著,具很強的乳化脂類的能力。膽酸多以其24位羧基與甘氨酸或牛磺酸的氨基以肽鍵結合為膽汁酸。膽汁酸既是脂類消化吸收的溶劑,也是膽固醇的排泄形式。在人類每日可有20~30g膽汁酸分泌到腸中,當消化的脂類在小腸上部被吸收後,膽汁酸也在小腸下部被回收,實際每日隻有約0.5g膽汁酸排出體外,其餘經門靜脈回到肝臟又可再分泌到膽汁中,這就是所謂腸肝循環。有采用阻止膽汁酸重吸收的藥物,以增加膽汁酸排出量,從而增加肝臟膽固醇轉變為膽汁酸的量,以期降低血漿膽固醇。一般情況,每日排出的1g膽固醇中,約半數以膽汁酸形式排出。未經轉變的膽固醇在糞便中被細菌還原為類固醇。
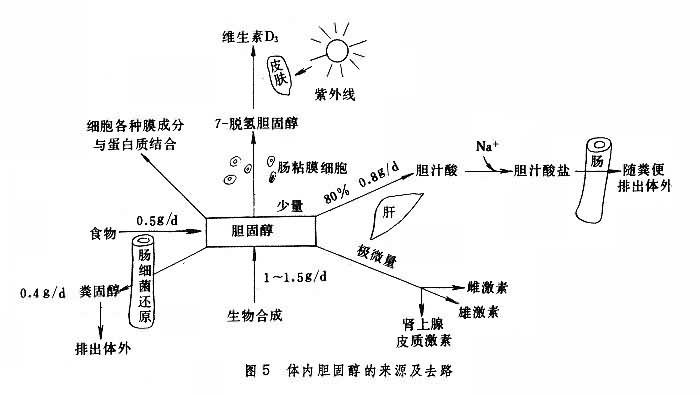
膽固醇與疾病的關系 體內膽固醇的來源及去路見圖5。正常人體內膽固醇的來源及去路處於動態平衡狀態之中,因此正常人血漿膽固醇濃度較穩定,約為110~230mg%。當血膽固醇濃度升高時,LDL濃度也會增高,前者稱為高膽固醇血癥;後者稱為高 LDL血癥;它們都與動脈粥樣硬化癥的發生有關,血中 HDL濃度升高有預防動脈粥樣硬化癥發生的作用,這是因為 HDL可將動脈壁內膜膽固醇運到肝臟進行代謝,起著清道夫的作用。對高血膽固醇血癥除應註意飲食外,可用降血脂藥治療。