熱力學函數之一。有兩種含義。英國和美國的冶金及一部分化學書刊中指的是等溫等壓下作判據的吉氏自由能G(Gibbs free energy),其定義為:
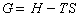 式中
<H為焓,
S為熵,
T為絕對溫度。德國和法國等歐洲大陸國傢稱吉氏自由能為
自由焓(free enthalpy),而蘇聯則稱之為等壓位(或等壓勢)。
式中
<H為焓,
S為熵,
T為絕對溫度。德國和法國等歐洲大陸國傢稱吉氏自由能為
自由焓(free enthalpy),而蘇聯則稱之為等壓位(或等壓勢)。
另一含義則為等溫、等容下作判據的赫氏自由能F(Helmholtz free energy),其定義為:
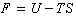 式中
U為內能。德、法等國稱赫氏自由能為自由能,而英國和美國的冶金書刊則稱之為功函或功含量,蘇聯則稱之為等容位(或等容勢)。
式中
U為內能。德、法等國稱赫氏自由能為自由能,而英國和美國的冶金書刊則稱之為功函或功含量,蘇聯則稱之為等容位(或等容勢)。
G和F的相互關系表達為:
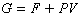 式中
P為壓力,
V為體積。從上式看出,在等壓等容條件下,
PV無變化,則:
式中
P為壓力,
V為體積。從上式看出,在等壓等容條件下,
PV無變化,則:
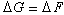 也就是說,對化學反應進行等溫等壓條件下的熱力學分析,參加反應的物質全部是凝聚態物質(固體或液體),因而其體積的變化可忽略不計時,反應的Δ
G等於Δ
F。
也就是說,對化學反應進行等溫等壓條件下的熱力學分析,參加反應的物質全部是凝聚態物質(固體或液體),因而其體積的變化可忽略不計時,反應的Δ
G等於Δ
F。
從定義的邏輯性出發,吉氏自由能稱為自由焓比較合理。
除瞭在高壓釜或密閉蒸餾器進行的反應外,冶金反應經常在定壓條件下進行;相變過程,特別是相圖的測定,一般是凝聚態且大都在1大氣壓下進行。因之,冶金工作者表達相律為:
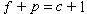 式中
c為組元數,
p為相的數目,f為自由度。因此自由焓是冶金工作者常用以判別冶金過程方向及平衡態的熱力學依據。但必須註意,此自由焓在英國和美國的冶金書刊中常稱為自由能。
式中
c為組元數,
p為相的數目,f為自由度。因此自由焓是冶金工作者常用以判別冶金過程方向及平衡態的熱力學依據。但必須註意,此自由焓在英國和美國的冶金書刊中常稱為自由能。