熱力學的基本定律之一,是能量守恆和轉換定律的一種表述方式。熱力學第一定律指出,熱能可以從一個物體傳遞給另一個物體,也可以與機械能或其他能量相互轉換,在傳遞和轉換過程中,能量的總值不變。它的另一種表述方式為:不消耗能量就可以作功的“第一類永動機”是不可能實現的。
18世紀以來,流行一時的“熱質說”相繼為 Count von朗福德、J.R.von邁爾、J.P.焦耳等人所推翻。他們證明熱是物質運動的一種表現,並逐步歸納成第一定定律的表述方式。其中焦耳於1840~1850年進行的熱功當量實驗為這一定律的科學表述奠定瞭基礎。焦耳的實驗表明,機械能所作的功W與其轉換得到的熱量Q之間存在著嚴格的數量關系,不管轉換的過程如何,一個單位的熱量永遠相當於E個單位的功,即W=EQ,式中E稱為熱功當量。在國際單位制(SI)中,熱量和功的單位都是焦耳(J),所以E=1。
對於封閉系統(見熱力系統),熱力學第一定律可表達為
Q=ΔU+W
或 δQ=dU+δW
它表明向系統輸入的熱量Q,等於系統內能的增量ΔU和系統對外界作功W之和。
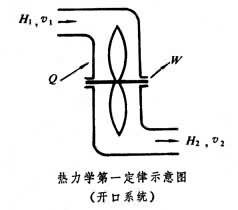
在熱工設備中經常遇到工質穩定地流入和流出設備的開口系統(見圖)的情形。這時,熱力學第一定律可表達為
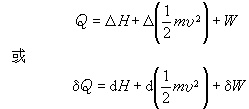 它表明向系統輸入的熱量
Q,等於質量為
m的流體流經系統前後
焓
H的增量、動能
它表明向系統輸入的熱量
Q,等於質量為
m的流體流經系統前後
焓
H的增量、動能
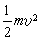 的增量以及系統向外界輸出的機械功
W之和。
的增量以及系統向外界輸出的機械功
W之和。