━━━━━━━━━━━━━━━━━━━━━━━━
基本概念
相
組分和組分數
自由度數目
相律
相圖
單組分系統的相平衡
二組分系統的相平衡
完全互溶雙液系的沸點
分餾原理
部分互溶雙液系的溶解度
完全不互溶雙液系的蒸氣壓和沸點
二組分系統的液固相平衡
二組分在固態時完全不互溶的系統
形成固溶體的二組分系統
三組分系統的相平衡
有一對部分互溶液體的三組分系統
三組分鹽水系統相圖
━━━━━━━━━━━━━━━━━━━━━━━
相平衡是在不同溫度、壓力和組成的條件下,化合物或混合物的各相之間的平衡關系,它可以確定組成與性質之間的定量關系,在鹽湖的綜合利用、合金的性能及其應用研究以及建築材料性質的研究方面有廣泛應用。
基 本 概 念
相 系統中任何一個均勻的、且可以用機械方法分離出來的部分,稱為一個相。因此,水、冰和水蒸氣是一種物質的三個相。一個相不一定隻含一種物質,所以一種溶液是一個相,各種氣體能以任何比例混合成一個相,幾種不同物質的固體混合起來所得的混合物系統(不包括固溶體),就有幾個相。碳酸鈣加熱分解為氧化鈣和二氧化碳,分解達平衡時,此系統中有兩個固相,即碳酸鈣和氧化鈣,一個氣相為二氧化碳。一個相不一定是連續的,它可以分裂成許多塊晶體或許多液滴。
組分和組分數 組分指已達成平衡的體系中各相的物質種類。一個單相系統的組分數是組成此系統的最少的物質數目,這幾種物質的物質的量必須指定,然後才能組成這個系統。例如取55摩爾水、0.8摩爾氯化鈉和0.3摩爾蔗糖組成一個單相系統,這個系統的組分數為3。一個單相系統的組分數並不一定等於此系統內的物質的種類數。例如有一個氣相中含有五氯化磷PCl5、三氯化磷PCl3和氯Cl2,且這三種物質處於化學平衡
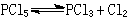 ,則這三種物質中任何一種物質的量均由另外兩種物質的量來決定。此時系統的組分數為2。如果此氣相中的
PCl
3和
Cl
2都是由
PCl
5分解而得,則
PCl
3的量必與
Cl
2的量相等,這三種物質中任何兩種物質的量均可隻由第三種物質的量來決定,於是此時此系統的組分數為1。綜上所述,一個單相系統的組分數
C為:
,則這三種物質中任何一種物質的量均由另外兩種物質的量來決定。此時系統的組分數為2。如果此氣相中的
PCl
3和
Cl
2都是由
PCl
5分解而得,則
PCl
3的量必與
Cl
2的量相等,這三種物質中任何兩種物質的量均可隻由第三種物質的量來決定,於是此時此系統的組分數為1。綜上所述,一個單相系統的組分數
C為:
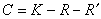
(1)
式中R為獨立的化學平衡的數目;R′為其他限制條件的數目;K為物質種類的數目。
對於一個多相系統,可首先列出各相的組分,然後挑選每一個相的作為系統組分的物質,挑選時應使盡可能多的組分是盡可能多的相所共同有的,這樣挑選出來的組分的總數目,就是此多相系統的組分數。例如有一系統由下列三個相組成:固相為固體物質氯化鈉,液相中有水、氯化鈉和乙醇,氣相中有水蒸氣和乙醇蒸氣,則此系統的組分數為3。應該註意,在多相系統中,如果有化學平衡存在,那麼用式(1)求出的組分數,應從中減去獨立的化學平衡個數,所得的差值才是此多相系統的組分數。例如,固體物質氯化銨分解生成氣態物質氨和氯化氫,達到平衡,按上述方法挑選得兩個組分(即氣相有一個組分,固相有一個組分)還應從中減去1(因系統中存在著一個化學平衡),故此兩相系統的組分數C=2-1=1。
自由度數目 一個相平衡系統的自由度數目,是為瞭確定系統中所有各相的強度性質時,在溫度T、壓力p和組成這些變量中,必須加以確定的變量的最小數目。
在一個隻有水蒸氣的系統中,必須同時確定此系統的溫度和壓力,才能確定此系統的全部強度性質,所以系統的自由度數目F=2。
在水和水蒸氣平衡共存的系統中,隻要確定溫度或壓力中任何一個變量,則另一個變量也隨之而確定,所以此系統的自由度數目F=1。
相律 相律如下式所示:
F=C-P+2 (2)
式中 P為平衡系統中的相的數目。相律是由 J.W.吉佈斯於1873~1878年提出的,廣泛用於非均相系統的研究方面。由相律可知,如果系統的組分數固定,相的數目愈大,則系統的自由度數目愈小。例如,在隻含水蒸氣的系統中,C=1,P=1,由式(2)得F=2。在水與水蒸氣兩相平衡共存的系統中,C=1,P=2,由式(2)得F=1,即系統的自由度數目比上例減少瞭。若此單組分系統的相數再增加,即水蒸氣、水、冰三相平衡共存,P=3,則由相律可知,F=0,即此系統沒有可任意改變的變量,三相平衡共存的系統的溫度和壓力以及其他各項強度性質都已由系統本身自然確定瞭。F分別等於0、1、2、3的系統各稱為不變系統、單變量系統、雙變量系統、三變量系統。
相律僅局限用於真正平衡的系統,在以上討論中忽略瞭諸如表面張力、電場、磁場和重力場的影響。
相圖 在不同條件下的相平衡情況應由實驗來測定。這種實驗結果可用圖表示出來,即為相圖。相圖所描述的都是系統處於平衡狀態的情況,相圖是根據實驗測定的數據作圖而得,還不能從理論上準確地預測相圖。
單組分系統的相平衡
單組分系統是一種純物質,沒有組成變量,隻須考慮溫度和壓力兩個變量。所有可能的相平衡關系均可用壓力-溫度圖表示。
系統隻有單相時,為雙變量系統,在圖1
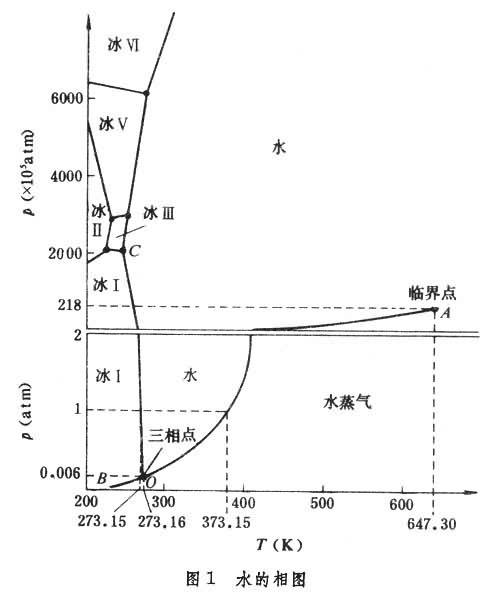 中用區來表示;當系統中兩相平衡共存時,在圖1中用線來表示;當系統中有三個相平衡共存時,為不變系統,在圖1中用點來表示。如果系統的溫度和壓力的點落在
A
O
C區內時,此系統全部是水;如果點落在
B
O
C區或
A
O
B區內時,系統分別為冰或水蒸氣。若系統的溫度和壓力的點落在
O
A線上,則系統為水和水蒸氣兩相平衡共存,
O
A稱為汽化曲線,此曲線表示水的蒸氣壓與溫度的關系。若系統的溫度和壓力落在
O
B曲線上,則系統為冰和水蒸氣兩相平衡共存,
O
B稱為升華曲線,此曲線表示冰的蒸氣壓與溫度的關系。若系統的溫度和壓力落在
O
C線上,則系統為水和冰兩相平衡共存,
O
C稱為熔化曲線,它表示冰的熔點與壓力的關系。
O
A、
O
B、
O
C三曲線的交點
O點,為水、水蒸氣、冰三相平衡共存點,此點稱為三相點。這個三相點隻能在
O點的溫度和壓力下平衡共存(273.16開、0.006大氣壓)。汽化曲線
O
A終止於
A點,即臨界點,水蒸氣和水變得不可區分,此時的溫度和壓力分別稱為臨界溫度和臨界壓力。
中用區來表示;當系統中兩相平衡共存時,在圖1中用線來表示;當系統中有三個相平衡共存時,為不變系統,在圖1中用點來表示。如果系統的溫度和壓力的點落在
A
O
C區內時,此系統全部是水;如果點落在
B
O
C區或
A
O
B區內時,系統分別為冰或水蒸氣。若系統的溫度和壓力的點落在
O
A線上,則系統為水和水蒸氣兩相平衡共存,
O
A稱為汽化曲線,此曲線表示水的蒸氣壓與溫度的關系。若系統的溫度和壓力落在
O
B曲線上,則系統為冰和水蒸氣兩相平衡共存,
O
B稱為升華曲線,此曲線表示冰的蒸氣壓與溫度的關系。若系統的溫度和壓力落在
O
C線上,則系統為水和冰兩相平衡共存,
O
C稱為熔化曲線,它表示冰的熔點與壓力的關系。
O
A、
O
B、
O
C三曲線的交點
O點,為水、水蒸氣、冰三相平衡共存點,此點稱為三相點。這個三相點隻能在
O點的溫度和壓力下平衡共存(273.16開、0.006大氣壓)。汽化曲線
O
A終止於
A點,即臨界點,水蒸氣和水變得不可區分,此時的溫度和壓力分別稱為臨界溫度和臨界壓力。
冰有同質多晶現象,即一種物質能以不止一種晶型存在。圖1中不同晶型的冰用不同的羅馬數字標明,各曲線的斜率dp/dT均可用克拉珀龍方程表示:
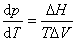
(3)
式(3)說明單組分系統兩相平衡時溫度T與壓力p的關系,ΔH和ΔV為一定量的該物質從一個相轉變為與之平衡共存的另一個相時的熱效應和體積變化。
如果參加平衡的兩相中有一相為氣相,氣相可視為理想氣體,即其p、V、T的關系符合理想氣體狀態方程,則考慮到物質為液相時的摩爾體積遠小於其為氣相時的摩爾體積,故前者可以忽略不計,於是式(3)可化為:
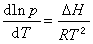
(4)
此式隻適用於有氣相參加的單組分兩相平衡系統,所以p為蒸氣壓;R為氣體常數,式(4)稱克勞修斯-克拉珀龍方程。
二組分系統的相平衡
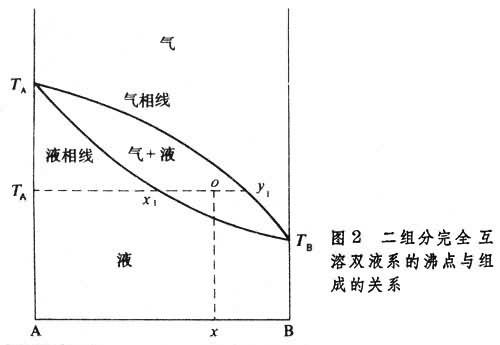
完全互溶雙液系的沸點 圖2 中A和B為兩個能完全互溶(能以任何比例互溶)的液體,純A與純B在給定壓力下的沸點分別為TA和TB,液相線表示沸點與液相組成的關系。設在一個密閉容器中整個系統的組成為x點所示,溫度為Tx,壓力固定。當平衡時,液相的組成為x1,而氣相組成為y1,聯結線y1x1被o點分成兩段。這兩段的比值y1o/ox1等於液相與氣相質量之比或物質的量之比,此規則對所有的兩相聯結線均適用,稱為杠桿規則。
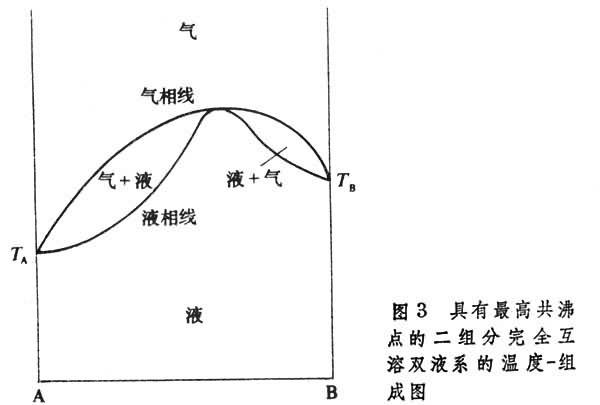
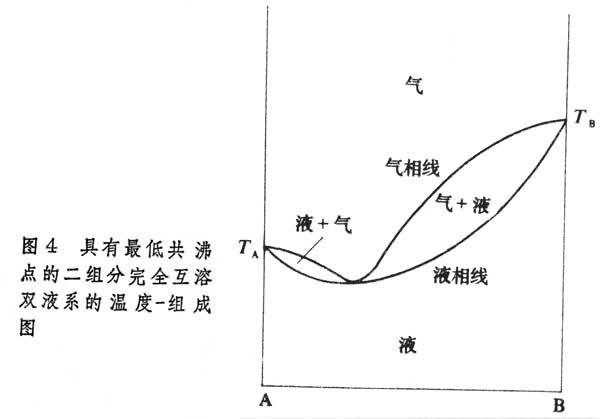
有些二組分完全互溶雙液系的溫度-組成圖有最高共沸點(圖3)或最低共沸點(圖4)。在這兩點處,氣、液相組成相同。若將這最低點或最高點組成的溶液進行蒸餾,所得餾出液的組成與原溶液相同,剩餘溶液的組成並不改變。這種現象稱為共沸。乙醇-水系統的沸點-組成圖屬於此類。
分餾原理 如圖5
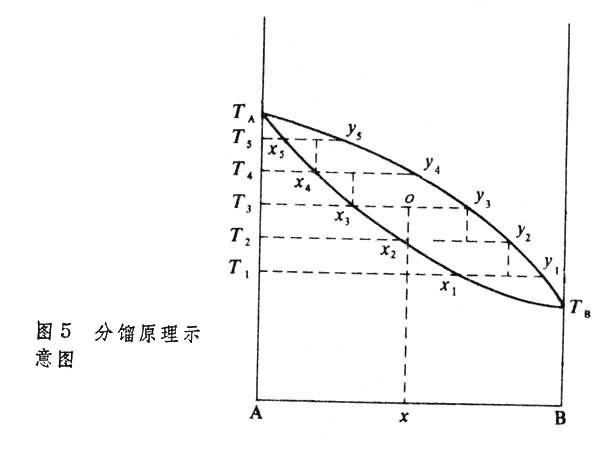 所示,設原始混合物的組成為
x,加熱到
T
3時系統的溫度和組成處於
o點,此時氣液兩相的組成分別為
y
3和
x
3。如果把組成為
y
3的氣相冷到
T
2,則部分氣體將冷凝為液體,得到組成為
x
2的液相和組成為
y
2的氣相。再將這部分組成為
y
2的氣相冷卻到
T
1,則此氣相又部分地冷凝為組成為
x
1的液相,同時得到組成為
y
1的氣相。依此類推,最後所得到的蒸氣組成可為純物質B。
所示,設原始混合物的組成為
x,加熱到
T
3時系統的溫度和組成處於
o點,此時氣液兩相的組成分別為
y
3和
x
3。如果把組成為
y
3的氣相冷到
T
2,則部分氣體將冷凝為液體,得到組成為
x
2的液相和組成為
y
2的氣相。再將這部分組成為
y
2的氣相冷卻到
T
1,則此氣相又部分地冷凝為組成為
x
1的液相,同時得到組成為
y
1的氣相。依此類推,最後所得到的蒸氣組成可為純物質B。
把組成為x3的液相加熱到T4,此液相部分地氣化,此時,氣液的成分分別為y4和x4。把組成為x4的液相再部分地氣化,則得到組成為y5的氣相和組成為x5的液相。最後得到純A。這樣,通過多次部分氣化和部分冷凝,使氣相組成沿氣相線下降,最後得到純物質B,液相組成沿液相線上升,最後剩餘的是純物質A。
部分互溶雙液系的溶解度 在恒定的壓力p和溫度T′下,向液相A中逐漸加入液體B,當加入少量的液體 B時,B能溶解而成勻相的混合物或溶液,直至組成為c時為止(圖6),
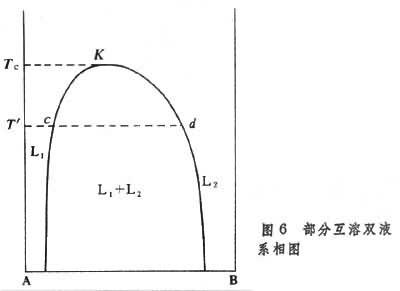 此後若再繼續向此混合物中加少量液體 B,則產生另一層液體,用
L
2表示,其組成為
d,而組成為
c的液體則用
L
1表示,組成為
c和
d的兩層液相平衡共存,稱為共軛溶液。
c層是B溶於A所形成的溶液,
d層是A溶於B所形成的溶液。
此後若再繼續向此混合物中加少量液體 B,則產生另一層液體,用
L
2表示,其組成為
d,而組成為
c的液體則用
L
1表示,組成為
c和
d的兩層液相平衡共存,稱為共軛溶液。
c層是B溶於A所形成的溶液,
d層是A溶於B所形成的溶液。
從圖6可見,液體物質A在液體物質B中的溶解度及液體物質 B在液體物質A中的溶解度均隨溫度升高而增加,即隨著溫度升高,兩液層L1與L2的組成愈來愈接近,至溫度為Tc時(圖6中的K點),兩液層的組成變為一致,此點的溫度稱為臨界溶解溫度,K點溶液的組成稱為臨界組成。
完全不互溶雙液系的蒸氣壓和沸點 在一定的溫度下,完全不互溶的兩種液體物質A和B構成的系統中,總的蒸氣壓p等於該溫度下純物質A和純物質B的蒸氣壓pA與pB之和,設mA和mB分別為此系統中平衡氣相中物質A和B的質量,nA與nB分別為物質A與B蒸氣的物質的量,ΜA與ΜB分別為物質A與B的摩爾質量,若將此平衡系統的蒸氣作為理想氣體處理,則有:
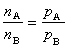
(5)
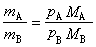
(6)
根據式(5)、(6),可算出餾出液中物質A和B的質量或物質的量的比值。
由p=pA+pB式可知,當p等於外壓時,這個雙液系統就達到其沸點,因為p比pA或pB都大,故知此雙液系的沸點比純物質A或純物質B的沸點都低。水汽蒸餾就是利用這一原理。若被蒸餾物質B的沸點很高,則用通常分餾方法時,物質B在沸點的高溫下發生分解;如果物質B與水完全不互溶,則可采用水汽蒸餾法,在比物質B和水的沸點都低的溫度時將物質B蒸出。
二組分系統的液固相平衡 二組分在固態時完全不 互溶的系統 分為三類:
① 具有簡單低共熔點系統的相圖,如圖7所示。
 T
A、
T
B兩點分別為純物質A和B的熔點。曲線
T
A
E為物質A的凝固點隨著所加入的物質 B的物質的量的增加而下降的情況,
T
B
E曲線的含義類似。直線
C
E
D為在三相平衡溫度下,連接三個相的組成點的直線。這三個相是固體純物質 A、固體純物質B和組成為
E的液相,此時
C=2,
P=3,
F=0,所以在固定壓力下,此三相平衡系統為不變系統,此時的溫度和各相的組成均固定不變,各相的組成和平衡溫度均由系統本身的性質來確定。
E點稱為低共熔點,其溫度比純物質A和純物質B的熔點都低。組成為E的液相析出的固體純物質A和固體純物質B的混合物稱為低共熔混合物,故低共熔混合物在熱力學上是兩相的。在低共熔混合物中,兩固體的物質的量或質量之比與組成為
E的液相中的相同。
T
A、
T
B兩點分別為純物質A和B的熔點。曲線
T
A
E為物質A的凝固點隨著所加入的物質 B的物質的量的增加而下降的情況,
T
B
E曲線的含義類似。直線
C
E
D為在三相平衡溫度下,連接三個相的組成點的直線。這三個相是固體純物質 A、固體純物質B和組成為
E的液相,此時
C=2,
P=3,
F=0,所以在固定壓力下,此三相平衡系統為不變系統,此時的溫度和各相的組成均固定不變,各相的組成和平衡溫度均由系統本身的性質來確定。
E點稱為低共熔點,其溫度比純物質A和純物質B的熔點都低。組成為E的液相析出的固體純物質A和固體純物質B的混合物稱為低共熔混合物,故低共熔混合物在熱力學上是兩相的。在低共熔混合物中,兩固體的物質的量或質量之比與組成為
E的液相中的相同。
制冷劑就是根據鹽水系統具有低共熔點的原理。例如固體物質碘化鉀-冰的混合物的溫度不能高於250.15開,這個溫度就是碘化鉀-水系統的低共熔點的溫度。
② 具有相合熔點的化合物的二組分系統的溫度-組成圖,如圖8所示。
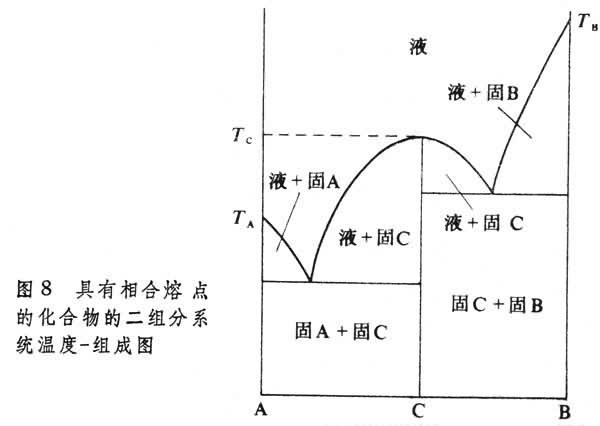 組分A和B可以形成另一個化合物C,其化學式以
A
x
B
y表示。圖8可以看成兩個類似於圖7的相圖合並而成,一個是組分A和組分C的二組分系統相圖;另一個為組分C和組分B的二組分系統相圖。化合物C在
T
c時熔融,所產生的液相的組成與固體化合物C的組成相同,這種化合物稱為相合熔點化合物。水-三氯化鐵(
H
2O-
FeCl
3)系統的相圖屬於此類,此系統會形成
組分A和B可以形成另一個化合物C,其化學式以
A
x
B
y表示。圖8可以看成兩個類似於圖7的相圖合並而成,一個是組分A和組分C的二組分系統相圖;另一個為組分C和組分B的二組分系統相圖。化合物C在
T
c時熔融,所產生的液相的組成與固體化合物C的組成相同,這種化合物稱為相合熔點化合物。水-三氯化鐵(
H
2O-
FeCl
3)系統的相圖屬於此類,此系統會形成
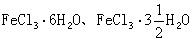 等相合熔點化合物。
等相合熔點化合物。
③ 形成不相合熔點化合物的二組分系統溫度-組成圖,如圖9 所示。
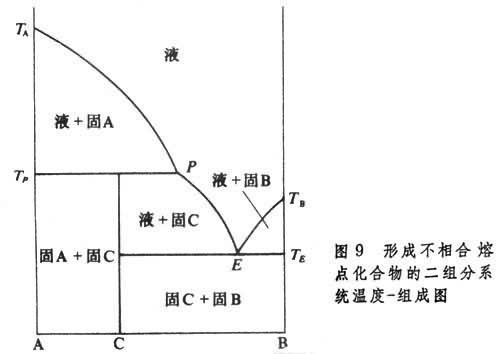 A和B兩組分形成的化合物為C,C的化學式用
A
x
B
y來表示。C在
T
P溫度時熔化成組成為
P的液相和固態純物質A,而液相的組成與固體化合物C不同,故C稱為不相合熔點化合物。此時固相A、固相C和組成為
P的液相三相平衡共存。由相律可知,在固定壓力下,此時系統為不變系統,系統內的反應可用下述化學反應式表示:固
A和B兩組分形成的化合物為C,C的化學式用
A
x
B
y來表示。C在
T
P溫度時熔化成組成為
P的液相和固態純物質A,而液相的組成與固體化合物C不同,故C稱為不相合熔點化合物。此時固相A、固相C和組成為
P的液相三相平衡共存。由相律可知,在固定壓力下,此時系統為不變系統,系統內的反應可用下述化學反應式表示:固
 。加熱時,此反應正向進行,當從系統取走熱量時,此反應逆向進行,但不論在正向反應還是逆向反應進行的過程中,系統的溫度和三相的組成都不變。
E點為低共熔點,在溫度
T
E時,組成為
E的液相與固相化合物C以及固相純物質B平衡共存,此時系統無獨立變量。
。加熱時,此反應正向進行,當從系統取走熱量時,此反應逆向進行,但不論在正向反應還是逆向反應進行的過程中,系統的溫度和三相的組成都不變。
E點為低共熔點,在溫度
T
E時,組成為
E的液相與固相化合物C以及固相純物質B平衡共存,此時系統無獨立變量。
形成固溶體的二組分系統 分兩類:①形成完全互溶固溶體的二組分系統的相圖,與完全互溶雙液系統的相圖類似。②形成部分互溶固溶體的二組分系統,又分兩種:第一種是具有轉變點的部分互溶二組分系統相圖(圖10)。
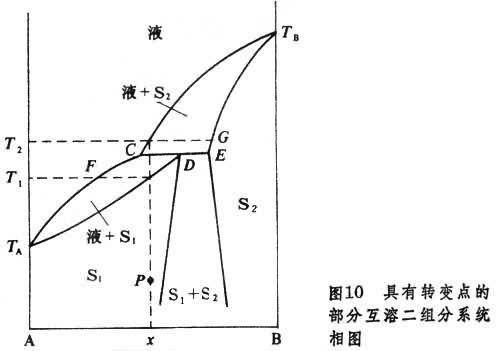 T
A和
T
B分別為純物質A與純物質B的熔點,
S
1和
S
2分別為兩種固溶體。將組成為
P的固溶體
S
1加熱,當溫度升至
T
1時,開始熔融,產生無限少量組成為
F的液相;繼續加熱,則固溶體
S
1不斷熔融,溫度不斷上升;當達到
C
D
E的溫度時,液相組成變為
C,
S
1固溶體的組成變為
D,並產生另一種固溶體
S
2,其組成為
E。如果繼續對此系統加熱,則
S
1不斷轉變為
S
2和組成為
C的液相,此時系統是在固定壓力下的二組分三相平衡系統,按相律可知自由度為零,故此時溫度和
S
1、
S
2以及液相的組成都不變,直到
S
1固溶體完全消失。此時若對系統繼續加熱,則溫度上升,液相組成沿曲線
C
T
B變化,
S
2固溶體的組成沿曲線
E
T
B變化,溫度達到
T
2,最後少量的
S
2固溶體(組成為
G)熔化。溫度繼續升高,系統中隻有一個液相,組成為
P。
T
A和
T
B分別為純物質A與純物質B的熔點,
S
1和
S
2分別為兩種固溶體。將組成為
P的固溶體
S
1加熱,當溫度升至
T
1時,開始熔融,產生無限少量組成為
F的液相;繼續加熱,則固溶體
S
1不斷熔融,溫度不斷上升;當達到
C
D
E的溫度時,液相組成變為
C,
S
1固溶體的組成變為
D,並產生另一種固溶體
S
2,其組成為
E。如果繼續對此系統加熱,則
S
1不斷轉變為
S
2和組成為
C的液相,此時系統是在固定壓力下的二組分三相平衡系統,按相律可知自由度為零,故此時溫度和
S
1、
S
2以及液相的組成都不變,直到
S
1固溶體完全消失。此時若對系統繼續加熱,則溫度上升,液相組成沿曲線
C
T
B變化,
S
2固溶體的組成沿曲線
E
T
B變化,溫度達到
T
2,最後少量的
S
2固溶體(組成為
G)熔化。溫度繼續升高,系統中隻有一個液相,組成為
P。
第二種是具有低共熔點的部分互溶固溶體的二組分系統的溫度-組成圖(圖11)。
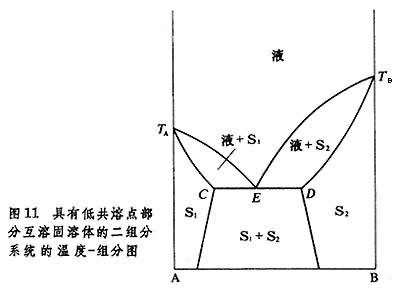 S
1與
S
2是兩種不同的固溶體,
E點為低共熔點,在此溫度時,如果從組成為
E的液相中取走熱量,則有
S
1和
S
2兩種固溶體同時析出,其組成分別為
C和
D,此時為三相平衡系統。在固定壓力下,系統為不變系統,溫度和各相組成均固定不變。
S
1與
S
2是兩種不同的固溶體,
E點為低共熔點,在此溫度時,如果從組成為
E的液相中取走熱量,則有
S
1和
S
2兩種固溶體同時析出,其組成分別為
C和
D,此時為三相平衡系統。在固定壓力下,系統為不變系統,溫度和各相組成均固定不變。
三組分系統的相平衡
三組分系統中,C=3,自由度數目F=C-P+2=5-P,故最多可有五相平衡共存。如果令三組分系統的溫度和壓力維持不變,則F=3-P,此時最大的自由度數目為2,於是系統的相圖可用平面圖來表示,此時的獨立變量則是組成。三組分系統的組成可以方便地用三角形圖來表示(圖12),
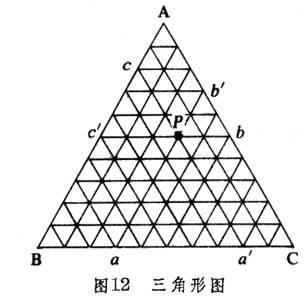 圖中等邊三角形的三個頂點用A、B、C分別表示三個純物質,三角形的每條邊表示相應的二組分系統的百分組成,三角形內的點則表示三組分系統的百分組成。如果通過三角形內任一點
P作直線
c′
P
b、
a′
P
c和
a
P
b′分別平行於三角形的各邊,則由幾何原理可以證明
P
a+
P
b+
P
c等於三角形一邊之長。令三角形的每條邊為100等分,則從
P
a、
P
b、
P
c三條線段的長度可分別得到
P點所代表的三組分系統中A、B、C三個組分的百分含量。
圖中等邊三角形的三個頂點用A、B、C分別表示三個純物質,三角形的每條邊表示相應的二組分系統的百分組成,三角形內的點則表示三組分系統的百分組成。如果通過三角形內任一點
P作直線
c′
P
b、
a′
P
c和
a
P
b′分別平行於三角形的各邊,則由幾何原理可以證明
P
a+
P
b+
P
c等於三角形一邊之長。令三角形的每條邊為100等分,則從
P
a、
P
b、
P
c三條線段的長度可分別得到
P點所代表的三組分系統中A、B、C三個組分的百分含量。
有一對部分互溶液體的三組分系統 三組分系統的三個組分中若有兩個組分(即一對)是部分互溶的,例如CHCl3-H2O-CH3COOH系統中,三氯甲烷CHCl3與水H2O是相互微溶的,而CHCl3和乙酸CH3COOH、H2O和CH3COOH這兩個二組分系統都是完全互溶的。此三組分系統在室溫和1大氣壓壓力下的相圖如圖13 所示,
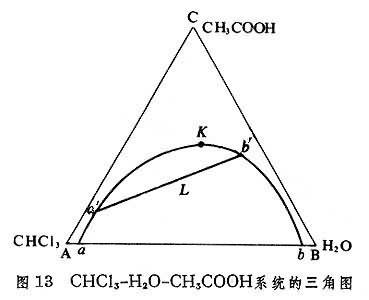 帽形曲線以外為單相區,而帽形曲線
a
K
b代表平衡共存的兩液相之組成,此曲線內的區為兩液相平衡共存區。例如,此區內組成為
L的系統,在平衡時,兩液相的組成分別為曲線
a
K
b上的兩點
a′與
b′。線段
a′
b′稱為聯結線,一般地說,
a′
b′不平行於
a
b。組成為
a′和
b′的兩液相互為共軛。若此三組分兩相系統中
CH
3COOH越多,則聯結線越短;當
CH
3COOH足夠多時,聯結線縮為一個點,如圖13中的
K,在此點,兩個共軛液相的組成相同,
K點稱為臨界點。
帽形曲線以外為單相區,而帽形曲線
a
K
b代表平衡共存的兩液相之組成,此曲線內的區為兩液相平衡共存區。例如,此區內組成為
L的系統,在平衡時,兩液相的組成分別為曲線
a
K
b上的兩點
a′與
b′。線段
a′
b′稱為聯結線,一般地說,
a′
b′不平行於
a
b。組成為
a′和
b′的兩液相互為共軛。若此三組分兩相系統中
CH
3COOH越多,則聯結線越短;當
CH
3COOH足夠多時,聯結線縮為一個點,如圖13中的
K,在此點,兩個共軛液相的組成相同,
K點稱為臨界點。
如果在純CHCl3中加入H2O,至系統的組成為a點時則達到飽和。如果再加入更多的水,則系統中出現第二個液相,其組成為b,即此時系統中有兩個液相平衡共存,其組成分別為a和b。a點為H2O溶於CHCl3中的飽和溶液,b點為CHCl3溶於H2O的飽和溶液。
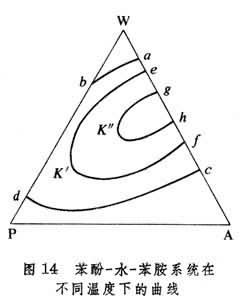
曲線aKb隻是在一個溫度下的曲線,而在其他溫度時,此曲線則呈另一形狀,不同溫度的帽形曲線可繪於同一圖中,例如圖14所示的為苯酚(P)-水(W)-苯胺(A)系統在不同溫度時的曲線,ab和dc是323.15開時的曲線,eK′f′是368.15開時的,gK″h為421.15開時的。
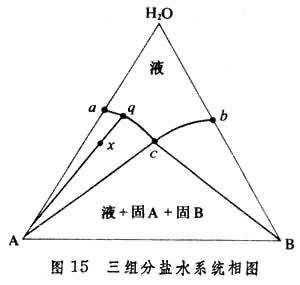
三組分鹽水系統相圖 由水和兩種鹽組成的相圖如圖15所示。物質A和B都是純的固態無水鹽,且這兩種鹽有一種共同的離子。圖中a為鹽A在水中的溶解度,b為鹽B在水中的溶解度。在隻溶有A的飽和水溶液中溶入B時,A的溶解度一般是要起變化的,ac曲線上的點均代表溶入B後能與固態純A呈平衡的溶液的組成;bc曲線含義類似。組成為c點的溶液可同時與固態純A和固態純 B呈平衡,此時在T、p固定的情況下,F=0,故此溶液的組成由系統自身性質決定而不能任意改變。Aac和Bbc兩區均為兩相區,分別為(液+固A)和(液+固B)。例如,在Aac區中有一組成為x的系統,在固定的溫度和壓力下,固相為固態純A,液相組成為ac曲線上的q,此點是直線Ax的延長線與ac曲線之交點。對於組成落在Bbc區內的系統,平衡時固相為固態純B,液相組成在bc曲線上。
曲線acb以上的區為單相區(液相)。組成點落在此區內的溶液,不論對固態純A或固態純B均不飽和。組成點落在ΔABc內的系統,為三相平衡系統,P=3,C=3。在溫度和壓力已固定的情況下,F=3-3+0=0,故三個相的組成均固定:為固態純A、固態純B、組成為c的液相。
參考書目
A.Findlay,A.N.Compbell and N.O.Smith,ThePhase Rule and Its Applications,9th ed.,Dover,New York,1951.