膠原是生物體膠原纖維的組成單元,是一種蛋白質;明膠是膠原的局部水解產物。在各門多細胞動物中都發現有膠原存在。在無脊椎動物中至少已知有10個門存在膠原,但這些膠原和哺乳動物的膠原在性質上有些差異。原生動物是否含有膠原還未最後肯定。在脊椎動物的皮膚、骨、軟骨、動脈管壁等組織內膠原含量特別高(見表)。膠原占人體或其他動物體總蛋白質量的25~30%,其功能主要是連接組織和器官(包括專門傳力的肌腱),支持體重(骨、軟骨)、保護機體(皮膚)等,在個體發育過程中還有協助助引導組織分化和器官形成的作用。不少疾病和膠原有關,如動脈硬化,肝硬化等。如果膠原的生物合成發生障礙,就會造成骨生成缺陷癥──一種嚴重的膠原病;還會造成其他的一些膠原病如當洛斯氏綜合征、表皮松解癥等。膠原自身的代謝一般比較緩慢,但在某些情況下,如動物體的生長、發育,以及組織損傷後的修復等過程中,膠原的生物合成往往比較活躍。
動物體內一些組織中膠原的含量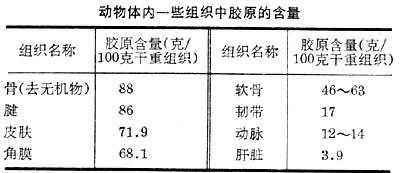
膠原的化學性質 生物體首先合成的是前膠原,它是由3個分子量約12萬的亞基組成的。前膠原經特殊的氨肽酶和羧肽酶水解除去氨基末端和羧基末端一段短肽鏈並經糖苷化後成為原膠原。原膠原經過氨基酸側鏈的交聯變為成熟的膠原。這些交聯反應通常是賴氨酸側鏈的氧化產物與其他氨基酸側鏈的加成反應。
膠原的氨基酸組成很有特點,甘氨酸約占三分之一,它還有11%的丙氨酸,12%的脯氨酸及9%的羥脯氨酸。膠原分子一級結構中存在一些重復的順序:甘-脯-x(x為羥脯氨酸或丙氨酸),或甘-x-y,(其中x、y為除甘氨酸外的其他氨基酸)。牛皮膠原的幾種α-鏈螺旋區的氨基酸順序已經闡明。
根據化學結構,膠原的多肽鏈有7種類型,用α1(Ⅰ),α2,α1(Ⅱ),α1(Ⅲ),α1(Ⅳ),α1(Ⅴ),α2(Ⅴ)表示,根據膠原所含的多肽鏈的類型不同,膠原本身又可分為5種,Ⅰ型膠原含有2條α1(Ⅰ)及一條 α2多肽鏈,Ⅱ型含有相等的3條α1(Ⅱ)多肽鏈,Ⅲ型膠原含有3條相等的α1(Ⅲ)多肽鏈,Ⅳ型膠原含有α1(Ⅳ)3條相等的多肽鏈,Ⅴ型膠原的結構尚未完全闡明,生物體各種組織含有的膠原類型不同,但以Ⅰ型膠原為主。
膠原的立體結構 與一般的球狀蛋白質完全不同,每一條亞基形成一股左手旋轉的螺旋,其中每3個氨基酸殘基形成一圈螺旋。3 條左手螺旋再扭在一起形成一個右手大螺旋。這樣的螺旋稱為3股螺旋。小的甘氨酸殘基位於3股螺旋內部。3股螺旋式的棒狀膠原分子的大小約是3000×15埃,這些棒狀分子首尾相連,並側向排列形成膠原微絲(其直徑可從50埃至數千埃)。膠原分子在兩端及沿軸向每隔680埃的距離存在極性區,這些極性區能和重金屬離子結合,使膠原纖維在電子顯微鏡下形成間距為680埃的明暗相間的特征性的橫紋結構。
由於膠原的特殊的立體結構,成年動物體的膠原是極穩定的。中國科學傢在研究長沙馬王堆西漢古屍時發現,保存2100多年的古屍組織中,膠原是所有蛋白質分子中保存最為完好的,其生物大分子的很多特性基本上和天然分子相同。在生理狀態的pH、溫度及離子強度等條件下,除膠原酶外,一般蛋白水解酶對膠原不易降解。
明膠 是膠原的部分水解產物,食品工業、制藥工業和照相工業中廣泛用作粘合劑和成形劑、中藥驢皮膠的主要成份也是明膠。明膠有 A型和B型兩類。A型明膠主要以豬皮等為原料,用酸水解方法制得,其等電點在pH7~9 之間。B型明膠主要從動物骨和皮中以堿水解方法制備,其等電點在pH4.6~5.2之間。明膠的分子量不均一,大部分商業明膠的分子量范圍是15000~250000之間,平均為50000~70000。
在0.4摩爾CaCI2溶液中,用蛋白水解酶處理膠原,然後在80℃和 pH7.0時用熱水抽提,可得分子量為95000的均一的 α-鏈明膠,在溶液中 α-鏈明膠的行為類似於無規卷曲構成的高聚物,而在凝膠狀態時可能含有高達70%以上的膠原螺旋構象。
明膠的氨基酸組成和膠原相似。明膠不溶於無水酒精,丙酮,四氯化碳,乙醚,苯,石油醚以及大部分非極性的有機溶劑,但可以溶解於水,醋酸和一些多元醇(如甘油,丙二醇,山梨糖醇和甘露糖醇)的水溶液。幹燥的明膠很易吸水,明膠水溶液的粘度隨濃度的增加及溫度的降低而增加。幹燥的明膠在室溫下,在密封容器中很穩定,可以保存多年。