表達化學元素的性質隨原子序數遞增而呈現週期性變化的表。元素週期表曾有過多種形式,如八音律、短表、長表、寶塔式表等。目前普遍使用的形式是長表,它與元素的原子核外電子排佈有很好的對應關係。原子核外的電子運動狀態很有規律,隻能在某些特定半徑、能量的軌道上運動,運動狀態不同,能量不同,可以分若幹層次,用K、L、M、N等表示1、2、3、4主層(電子層)。在相同的主層內,還可以分為若幹電子亞層,用s、p、d、f標明,,相應的滿層電子數分別為2、6、10、14。主層和亞層相同的電子能量幾乎相等,處於同一“能級”。凡能量差不多的能級合在一起成為一個“能級組”。
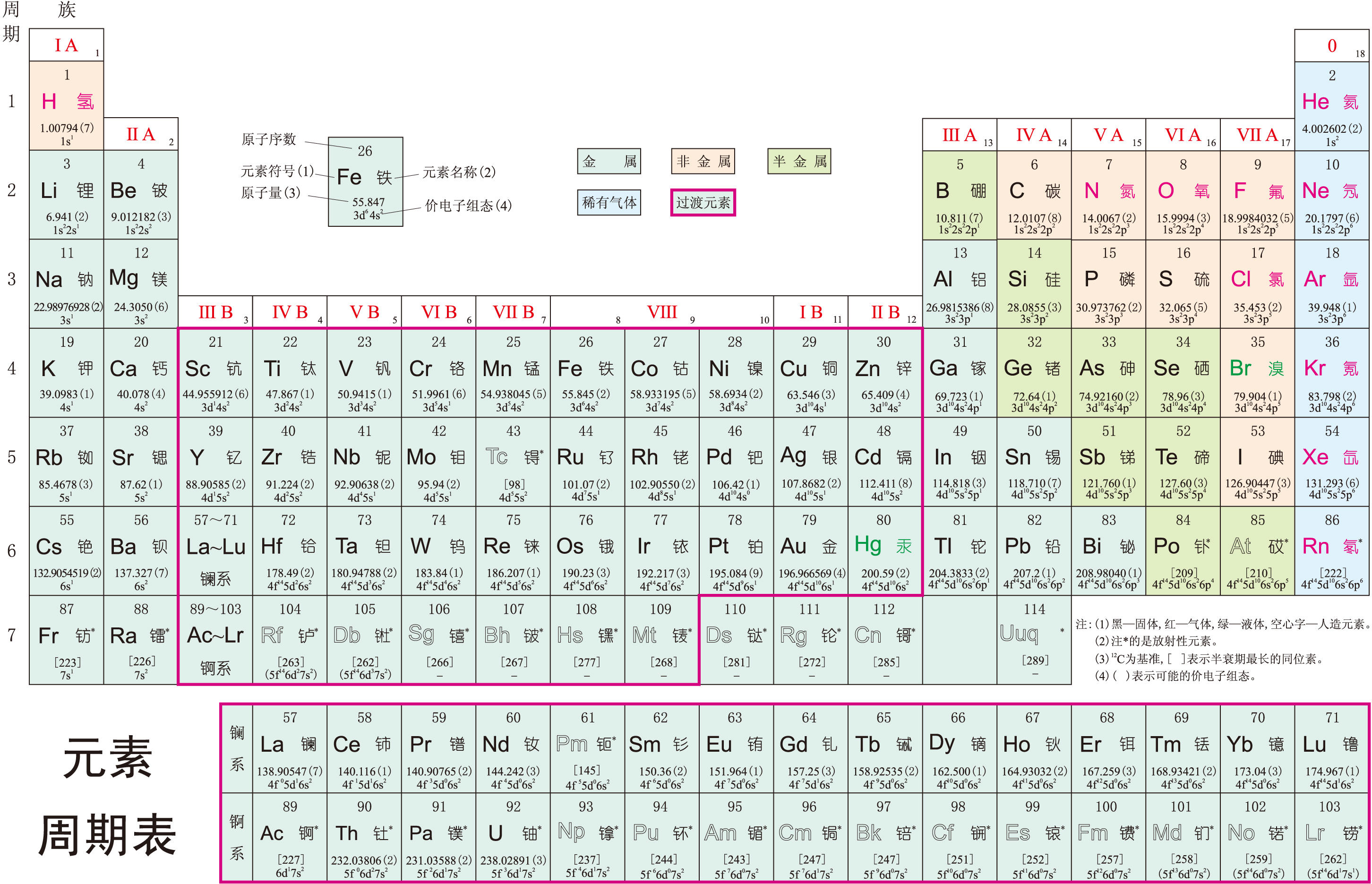
在周期表中元素按核外電子數的多少依次排列,每種元素占一格,標明瞭該元素的名稱、符號、原子序數及價電子組態、原子量、晶形、原子半徑等。橫向共7個周期,豎向共18縱列(族)。
周期 按原子核外電子能量,元素可劃分為7個能級組:1s、2s2p、3s3p、4s3d4p、5s4d5p、6s 4f 5d 6p、7s 5f 6d 7p。各能級組間能量差別較大,組內不同亞層能量差別較小。同一個能級組的元素構成一個周期。前3個周期是短周期,相應元素數是2、8、8;其餘為長周期,相應元素數為18、18、32,第7周期應該有32種元素但尚未全部發現,其中自95號镅Am起的元素,都是人工合成的元素,在自然界不存在。57號元素鑭La到71號元素镥Lu共15種擠在第6周期第3縱列的一個空格裡,總稱為鑭系元素,放在周期表下方一一排開;第89~103號錒系元素也排在表的下方。
在同周期的元素中短周期從左到右原子半徑顯著減小;長周期中從左到右總的趨勢是半徑減小,但改變緩慢;鑭系、錒系元素原子半徑改變更小。
族 與化學反應密切有關的是那些核外電子中能量較高的外層(最外層或最外2層)電子,稱為價電子或外圍電子。價電子組態類同的元素,在周期表裡位於同一縱列,如堿金屬族元素原子的最外層電子排佈都是ns1。同族元素性質相似,從上到下原子半徑增大。
18個縱列中第8~10三縱列為第Ⅷ族,其他15個縱列各標為一個族。凡價電子組態為s、p的為主族標為A,位於周期表左右兩側;凡價電子含d、f的為副族標為B,占周期表中間部位。如氟、氯是第17列的典型元素,與溴、碘、砹稱為第7主族(ⅦA)元素,它們的最外層電子排佈為ns2np5,共7個電子;而把外層電子排佈為ns2(n-1)d5,即次外層d亞層上電子數和最外層s亞層電子數總和是7的第7列元素錳、锝、錸稱為第7副族(ⅦB)。
1989年國際純粹與應用化學聯合會的無機化學命名委員會提出用18族表示族號,即第1族是原先的ⅠA(堿金屬族)、11族是原先的ⅠB(銅族),17族是原先的ⅦA(鹵族)。
元素分類 元素中絕大多數是金屬,它們集中在長表的左邊,金屬性最強的是鈁,位於周期表的左下角;少數非金屬元素集中在周期表的右上部分,非金屬性最強的氟位於周期表的右上角。根據充填最後1個電子能級(價電子組態)的不同可將元素分為s、p、d、f四個區。參照元素周期表縱列橫行中元素間的關系,分區瞭解各類元素的通性和個性是掌握化學知識的有效途徑。
①s區元素。最後1個電子充填在s亞層上,包含ⅠA和ⅡA兩族的13種元素,它們都容易失去電子形成離子型化合物,在自然界共生。單質有輕、軟、熔點低等共同的物理性質,化學性質活潑;氫氧化物都顯堿性,多數鹽類易溶於水。
②p區元素。最後1個電子充填在p亞層上,包括第13~18縱列的ⅢA、ⅣA、ⅤA、ⅥA、ⅦA和0族6個主族的元素,它們的化學性質比s區復雜得多。以硼B、矽Si、砷As、碲Te、砹At為斜角線將p區一分為二,右上方為非金屬,左下方為金屬,介於非金屬和金屬之間的是半金屬,重要的半導體材料都由這條斜角線周圍的元素所組成。p區元素價電子層中p電子和s電子都能參與成鍵,同一元素可以生成多種不同價態的化合物。其中碳C、氮N、氧O、磷P、硫S、氯Cl等都是常見而有廣泛應用價值的元素。0族元素為稀有氣體,其sp外層已充滿,化學性質呈惰性。
③d區(包括ds區)元素。最後1個電子充填在d亞層上,位於周期表中間位置,由第3縱列ⅢB至第12縱列ⅡB,共10個縱列的元素,它們都是副族元素,又稱過渡元素。因它們外圍電子排佈差別主要在次外層上,所以(同周期內)從左到右相鄰元素性質差別較小,甚至出現相鄰元素性質的相似性超過同族元素性質的相似性。由於np和nd能級都空著,並且次外層的(n-1)d也未完全充滿,這些空的能級既可容納激發電子,也可參與多種形式的雜化,然後與其他原子形成化學鍵。變價多,容易形成比較復雜的配合物,化合物顏色多樣。由於鑭系收縮致使第6周期鉿Hf、鉭Ta、鎢W的原子半徑分別和第5周期同族的鋯Zr、鈮Nb、鉬Mo的原子半徑相近,因此鉿和鋯、鉭和鈮、鎢和鉬之間的化學性質非常相似,並且也因此第6周期從鉿開始都是很重的金屬,其中最重的是鋨Os,密度22.48克/厘米3。熔點最高的、硬度最大的金屬也在這個區裡。各式各樣新材料如催化劑、超導體、高能電池、高溫合金等都與d區元素有關。
④f區元素。最後1個電子充填在f亞層上,包含第3縱列第6周期鑭系和第7周期錒系的30種元素,又稱內過渡元素。因最外2層電子排佈相同,所以鑭系元素性質相互間極為相似,性質復雜多變,在自然界共生,分離提純相當困難。