測定有機化合物中各種元素含量的儀器。是在經典的元素分析方法基礎上,結合現代化的分離、檢測技術,進行條件控制和資料處理的自動化儀器。方法簡便、迅速,逐漸取代瞭經典的元素分析方法。
碳、氫的分析 原理是1830年J.von李比希所建立的碳、氫燃燒法,即先稱取幾十毫克樣品載於小舟中推入燃燒管裏加熱,用紅熱的氧化銅氧化,然後將燃燒產生的水和二氧化碳用純氧氧氣流趕到含有高氯酸鎂及燒堿石棉劑的吸收管內,前者將排出的水吸收變為結晶水高氯酸鎂(用其他高效水吸收劑也可),後者將二氧化碳轉變為碳酸鈉(圖1)。這兩個吸收管的增重分別表示生成的水和二氧化碳的重量,由這些數據即可計算分子中碳和氫的含量。如果樣品中含有鹵素或硫,則可在燃燒管內填充銀絲而除去;氮燃燒生成的氮氧化物則可另用一個內含二氧化錳的吸收管吸收並測量。
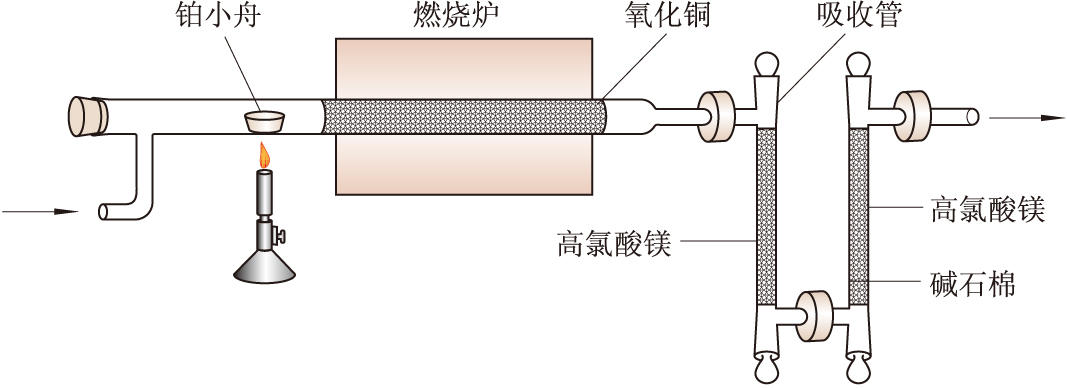 圖1 碳氫分析儀示意
圖1 碳氫分析儀示意
現代的微量技術是在兩個吸收管前後各加一熱導池檢測器,分別測出水和二氧化碳的含量;或取消吸收管,將燃燒產生的氣體直接通過氣相色譜法、庫侖分析或電導分析等相應的方法測定。
氮的分析 1833年由J.-B.-A.杜馬建立,後改進為微量技術。其測定原理為在高溫下將樣品氧化,氧化所得的二氧化碳和水分別用上法吸收,氮則轉變為氧化物,以二氧化碳為載氣,將氮氧化物通過裝有金屬銅絲的還原管(保持在500~600℃),銅即將氮氧化物還原為氮氣。這些氣體均通入氮量計(圖2)內,氮量計中裝滿氫氧化鉀溶液,除氮氣外,其他氣體均被氫氧化鉀溶液吸收,因此可讀取氮量計中氮氣的體積,並校正至標準狀態,由此求得樣品中的氮含量。氮在有機物中的含量也可用克達爾法測定,1883年由J.G.C.T.克達爾創造,適用於蛋白質、氨基酸、氨基有機化合物。其測定原理為將樣品用濃酸(如硫酸)消化,氮以銨鹽形式存在於溶液中,然後將消化液堿化,進行水蒸氣蒸餾,氨即隨水蒸氣蒸出,用弱酸吸收,然後再用標準強酸滴定,求出氮的量。
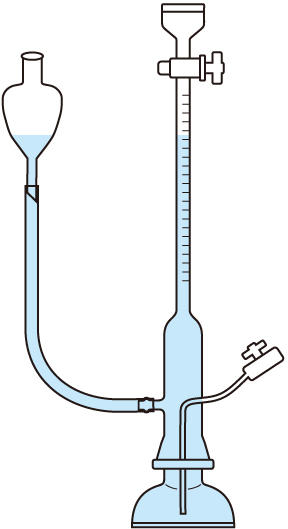 圖2 氮量計示意
圖2 氮量計示意
氧的分析 前面碳、氫、氮的元素分析均不包含氧的分析。過去也不分析氧的含量,而通常求得以上3種元素和其他元素的百分數之後,把餘下的百分數作為有機物中的氧含量。若樣品中其他元素的百分數總和等於100,則表明該化合物不含氧。至20世紀50年代人們找到瞭分析氧含量的方法。其原理如下:把有機物在高純惰性氣體(常用氮)中高溫熱解,產物通過鉑族碳催化劑,使含氧物質均轉化為一氧化碳,再用五氧化二碘或無水碘酸將一氧化碳轉化為二氧化碳,同時釋放出碘,用重量分析測定二氧化碳或碘,再算出氧含量。也可用熱導池直接檢測一氧化碳,或直接用庫侖分析法測定二氧化碳的含量。
鹵素分析 20世紀50年代末W.舍尼格爾發明瞭氧瓶法破壞有機試樣,簡單易行,許多元素的測定均采用瞭這個方法。氧瓶法是將瓶內放好吸收液,充滿氧氣,稱好的試樣用濾紙包好,放在瓶塞下面固定的鉑絲圈內,用火點燃濾紙後立即放入瓶內塞好,使其燃燒分解,吸收液多用稀堿溶液,氯化物被吸收後即可用硝酸銀或硝酸汞標準溶液滴定。溴或碘化物在吸收後尚需用還原劑處理,將氧化至高價的溴和碘還原至負離子後再用銀量法或汞量法滴定。也可用離子選擇性電極直接測量。
硫、磷的分析 氧瓶法把有機物氧化為相應的氧化物,硫被氧化為硫酸根,然後用氯化鋇滴定。磷被氧化為磷酸根,用磷鉬酸比色法或者生成磷酸銨鎂沉淀後,用乙二胺四乙酸滴定過量的鎂而求出磷含量。
金屬的分析 多用灰化法,將樣品灼燒,由殘渣求出金屬含量。大多數金屬形成的離子可用原子吸收光譜法,進行定性和定量測定。也可用各種光譜化學分析(如發射光譜法、紫外–可見分光光度法、熒光分析)、電化學分析法(如電位分析、庫侖分析、極譜法和伏安法)等。