化學元素,元素符號O,原子序數8,原子量15.999 4,屬週期系ⅣA族。典型的非金屬元素。
發現 1773年C.W.舍勒在加熱硝酸鉀、氧化汞、碳酸銀時得到氧,但未能認識它。1774年J.普裏斯特利用透鏡聚焦太陽光使汞的煆灰(氧化汞)分解得到汞珠和一種有強烈助燃性的氣體。1774年法國A.-L.拉瓦錫製備、研究瞭這種氣體,確定它它存在於多種物質中並是酸的組成成分,因此命名為oxygene,來源於希臘文,原意為“酸形成者”。
存在 氧是地殼中最豐富的、分佈最廣的元素,在地殼中的含量為48.6%。單質氧在大氣中占23.0%(質量百分)、20.946%(體積百分),在水中占88.81%,海水中占85.8%,約占人體65%。物質燃燒和氧化過程、動植物呼吸消耗氧氣,而植物的光合作用生成氧氣,就使在大氣中氧氣含量幾乎保持不變。氧有三種穩定同位素,即16O、17O、18O,其中16O含量最高,為99.757%。
物理性質 在常溫、常壓下,氧為無色、無臭和無味氣體,密度1.429克/厘米3。固態氧呈亮藍色,熔點−218.79℃。液態氧呈淺藍色,具有順磁性,不導電,沸點−182.95℃,可作為低溫溫標。氧分子不易分解為氧原子,隻是在1 500℃開始分解,到5 000℃可以完全分解。鉑黑、活性炭以及熔融態的貴金屬可以大量地吸收氧。
化學性質 氧原子的電子組態為1s22s22p4,氧化數-2、-1、+2,氧原子的電負性僅次於氟。除稀有氣體、鹵素及少數貴金屬(如金、鉑等)外;氧能與所有的金屬和非金屬直接反應,生成氧化物。通過間接作用氧和鹵素等形成相應的化合物,如Cl2O、I2O5、XeO3、Au2O等。
氧與葡萄糖的作用是構成生物的呼吸作用的主要反應。
物質氧化的速度決定於被氧化物質的性質、溫度和反應條件。有些物質(如NO、血紅蛋白)在室溫下立即與氧化合,有些物質的氧化則需要加熱才能進行,有些物質需要借助催化劑才能發生氧化,如O2和NH3的作用必須在鉑的催化下才能生成NO。物質和氧反應有的很快,常伴隨發熱和燃燒;有的很慢,如金屬銹蝕。若緩慢的氧化反應釋熱不易擴散,可能造成自燃,如煤堆自燃。
正常氧化物中氧的氧化數為-2,過氧化物H2O2、超氧化物Ba(O2)2、臭氧化物KO3中氧的氧化數依次為-1、-1/2、-1/3,此外還有低氧化物如Cs7O。氧分子甚至還可失去一個電子,生成二氧基正離子O2+,如O2PtF6。氧分子中氧原子上的弧對電子,可和某些金屬離子配位,如血紅素中亞鐵卟啉衍生物中的亞鐵離子,可以和氧分子可逆地結合,起到向人身各部分輸氧供氧的作用。
氧分子的順磁性表明有未成對的單電子。
實驗室制法 主要是利用某些含氧酸鹽熱分解,如:
2KClO 3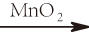 2KCl+3O
2
2KCl+3O
2
過氧化氫分解或往酸性過氧化氫溶液滴加高錳酸鉀溶液,或電解硫酸、氫氧化鈉水溶液均可產生氧:
2H 2O 2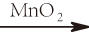 2H
2O+O
2 2KMnO
4+5H
2O
2+3H
2SO
4 輩 K
2SO
4+2MnSO
4+5O
2+8H
2O 2H
2O
2H
2O+O
2 2KMnO
4+5H
2O
2+3H
2SO
4 輩 K
2SO
4+2MnSO
4+5O
2+8H
2O 2H
2O
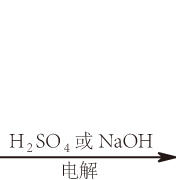 2H
2+O
2
2H
2+O
2
工業制法 大規模生產氧,可采用液態空氣分餾的方法。氮的沸點(-195.79℃)低於氧,分餾出氮可得純度高達99%的工業用氧。把氧氣加壓(1.5×107帕)儲存在鋼瓶中運輸和備用。從空氣中制取氧的幾種新的方法是:因氧氣有順磁性,可在磁場作用下從空氣中富集氧,經多次富集可得純度達90%以上的氧氣。利用膜分離富集空氣中的氧氣,經25×10-6米厚的乙基纖維素均質膜一次(級)富集分離,O2的含量達33%,經五級分離得含量為91%的氧氣。鋰離子交換的X型分子篩可以選擇性吸附空氣中的氮,也能從空氣中分離制得純氧。
應用 氧氣不但是動植物呼吸、物質燃燒不可缺的物質,冶金工業中熔煉、精煉,金屬材料切割、焊接,煤的氣化等都要用到氧;液氧是火箭推進劑中的氧化劑;廢水處理需氧,危重病人急救、高壓氧艙都離不開氧。