用離子間靜相互作用模型和玻耳茲曼分佈定律定量地說明稀溶液熱力學性質活度係數、凝固點降低、滲透壓、稀釋熱的理論。
德拜-休克爾理論 理論的基本假設是:①在稀溶液中電解質完全離解;②離子是不會被極化的帶電圓球,其電場具有圓球對稱性;③離子之間隻有庫侖力起作用,其他分子間力可忽略不計;④離子相互作用產生的吸引能小於熱運動能;⑤溶液與溶劑的介電常數相等。
溶液中的離子是不斷運動的,設想有一個中心離子j,根據假設②,這個中心離子外圍的離子分佈為一個球形對稱的電荷分佈,稱為離子氛,它的凈電量與中心離子的電量大小相等,符號相反。應用靜電理論的泊松方程,將空間某一點的電位與電荷密度聯系起來,采用玻耳茲曼分佈定律的級數展開式,並根據上述假設作適當近似處理,計算出某點的電荷密度,然後得出與中心離子j相距r處的電位Ψ為:
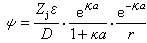
(1)
式中Zj為j離子的電價;D為溶劑的介電常數;ε為質子電荷;a為正負離子有效半徑之和;κ見下式:
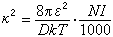
(2)
式中k為玻耳茲曼常數;T為熱力學溫度;N為阿伏伽德羅數;I為離子強度:

(3)
式中ci為離子體積摩爾濃度。ψ是中心離子在該點的電位Zjε/(Dr)與離子氛電位φ(r)之和,所以離子氛電位為:

(4)
當r=a時,φ(a)為離子氛在中心離子j處的電位:
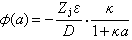
(5)
離子氛電位φ(a)與中心離子 j相互作用所引起的電能變化,即離子相互吸引在一個j離子上所引起的電能變化為:

(6)
因子1/2是由於每個離子既作中心離子,又作離子氛中的離子,而使計算進行瞭兩次,所以應除以2。假設離子溶液之所以不能成為理想溶液完全由於離子相互作用,因此1摩爾j離子的吉佈斯函數,即j離子的化學勢μj可以寫成:

(7)
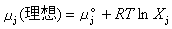
(8)
式中μj°為j離子的標準化學勢;Xj為j離子的摩爾分數,R為氣體常數。對非理想溶液,則有:
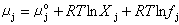
(9)
式中fj為j離子的摩爾分數標度的活度系數,可得:
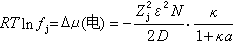
(10)
因此,電解質的平均活度系數為:
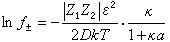
(11)
將式(2)代入式(11),並令a=a°×10-8,則式(11)可簡化為:

(12)
式(12)就是德拜-休克爾電解質活度系數公式,式中

。對298K的水溶液,A=0.5115;B=0.3291。用式(12)可以準確計算I=0.1以下的溶液活度系數。對高度稀釋的溶液,
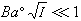 ,可以忽略不計,就可得出德拜-休克爾極限公式:
,可以忽略不計,就可得出德拜-休克爾極限公式:
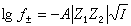
(13)
離子活度系數的水化理論 這一理論把德拜-休克爾理論的應用范圍推廣到較高濃度的水溶液,認為離子由於與水分子的相互作用而水化,水化離子與無水離子不是完全相同的物質,兩者的化學勢應有差別。水的化學勢是1摩爾水加入無限量一定濃度的溶液所引起的吉佈斯函數的改變量,與水化無關,但自由水分子數因水化而減少,一定量溶液的吉佈斯函數為固定值。德拜-休克爾電解質活度系數公式也適用於水化離子。應用上述原則導出一個包含離子水化數h和適合於較濃的水溶液的電解質活度系數公式。如果1摩爾電解質溶於s摩爾水中,成為v1和v2摩爾的正負離子,則有:

(14)
式中aw為水的活度;v=v1+v2。如果以質量摩爾濃度m為溶液濃度的標度,以滲透系數φ表示水的活度,則有:
lnaw=-0.018vmφ (15)
用質量摩爾濃度為標度的活度系數γ±為:
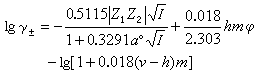
(16)