對雙分子反應A+B─→C+D,設A和B的相對運動速度為V,則在長度為v,底面積為S(v)的圓筒內一個A分子與B分子碰撞的頻率為ZB(v)=S>(v)VnB,單位體積內所有A分子的碰撞頻率為ZAB=ZB(v)nA,式中nA、nB分別為A分子和B分子的密度,S(v)為分子對的碰撞截面,若S(v)為有效截面,即每一碰撞均發生化學反應的反應截面,則反應速率為:

從化學動力學可知:
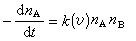
所以k(v)=S(v)V,對速率求平均則得:
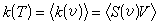
式中k(v)稱為該給定反應在給定運動速率下的反應速率常數,而k(T)則稱為給定溫度T下的熱平衡反應速率常數。