能與抗原特異性結合並具有免疫活性的球蛋白。它一般是由抗原刺激 B細胞分化成漿細胞後產生的。抗體分子具有結合部位(結合簇),能與對應的抗原決定簇結合。抗體與不同的抗原結合往往出現不同的反應,因而常給抗體以不同的名稱,如凝集素、沉澱素、抗毒素、溶血素、溶菌素等。1938年,A.蒂塞利烏斯和E.A.卡巴特用電泳技術發現,血清中的抗體活性存在於γ區,因而曾稱其為丙種球蛋白。已證明抗體主要存在於γ區,有的抗體延至β甚至α區。位於γ區的球蛋白也不一定都具有抗體活性。11964年,世界衛生組織專門會議將具有抗體活性的球蛋白統一命名為免疫球蛋白(Ig)。抗體是Ig,但Ig不一定是抗體。
按來源抗體可分為天然抗體和免疫抗體。免疫抗體是由抗原刺激機體產生的,如受微生物感染或接種疫苗後產生的抗體;按其作用可分為抗毒素(能中和細菌外毒素毒性的抗體)、抗菌抗體(能與細菌結合的抗體)和抗病毒抗體(能與相應病毒結合的抗體);按其與抗原結合後是否出現可見反應,則可分為完全抗體和不完全抗體。前者指在試管中與相應抗原結合後,在電解質的參與下,出現可見反應的抗體;後者指在結合後不出現可見反應的抗體。
免疫球蛋白 存在於血漿中的、參與免疫反應的球蛋白。其組成、結構、大小、電荷、生物學活性等極不一致。已發現有5大類:免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)(圖1)。
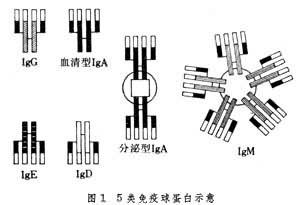
基本結構 Ig的基本結構相似,都是由兩條相同的長肽鏈(重鏈)和兩條相同的短肽鏈(輕鏈)通過二硫鏈連接而成。輕鏈可分成 κ型和λ型,它們的氨基酸組成和抗原性不同;重鏈可分為γ、α、μ、σ和ε型,它們的氨基酸組成和抗原性也不同。在一個免疫球蛋白的分子中,兩條輕鏈相同,兩條重鏈也相同,沒有混合型的。兩條輕鏈通過鏈間二硫鍵分別與相鄰的重鏈連接,兩條重鏈再通過二硫鍵連接起來。除鏈間二硫鍵外,輕鏈和重鏈都各自有鏈內二硫鍵。輕鏈有兩個鏈內二硫鍵,構成兩個環肽,每環約有60個氨基酸殘基;重鏈有4或5個鏈內二硫鍵,構成4或5個環肽,每環約有60個氨基酸,稱為功能區。
每條重鏈或輕鏈又分為兩個部分。以 IgG結構為例(圖2),
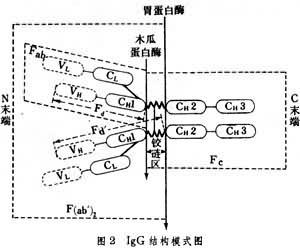 多肽鏈氨基端(N端)即輕鏈的1/2與重鏈的1/4,這個區氨基酸的組成及排列順序,隨抗體分子而千變萬化,稱為可變區(V區)。輕鏈V區簡寫成
V
L,重鏈V區簡寫成
V
H。多肽鏈羧基端(C端)即輕鏈的1/2與重鏈的3/4,這個區氨基酸的排列順序比較穩定,稱為恒定區(C區)。輕鏈C區簡寫成
C
L,重鏈C區簡寫成
C
H。
V
L和
V
H構成Ig的抗原結合部位,可與抗原呈特異的結合。在
V
L和
V
H區中,有些區域氨基酸的組成變化大,因而稱為超變區或高變區。輕鏈上常有3個超變區;重鏈上有4個超變區。超變區與Ig的抗原結合部位的組成有關。恒定區與穿透胎盤、結合補體或吸附於細胞等生物性功能有關。
多肽鏈氨基端(N端)即輕鏈的1/2與重鏈的1/4,這個區氨基酸的組成及排列順序,隨抗體分子而千變萬化,稱為可變區(V區)。輕鏈V區簡寫成
V
L,重鏈V區簡寫成
V
H。多肽鏈羧基端(C端)即輕鏈的1/2與重鏈的3/4,這個區氨基酸的排列順序比較穩定,稱為恒定區(C區)。輕鏈C區簡寫成
C
L,重鏈C區簡寫成
C
H。
V
L和
V
H構成Ig的抗原結合部位,可與抗原呈特異的結合。在
V
L和
V
H區中,有些區域氨基酸的組成變化大,因而稱為超變區或高變區。輕鏈上常有3個超變區;重鏈上有4個超變區。超變區與Ig的抗原結合部位的組成有關。恒定區與穿透胎盤、結合補體或吸附於細胞等生物性功能有關。
水解分段 用木瓜蛋白酶可將IgG水解成3段:兩個Fab段和一個Fc段。Fab段為能與抗原結合的部分,不過是單價的(一般抗體都是兩價的),由一條輕鏈和靠N端的半條重鏈(稱為Fd段)構成。如用胃蛋白酶水解,可將IgG重鏈間二硫鍵近C端切斷,得到一個具有兩價抗體活性的F
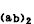 段,還有
F
c段的小部分(此時
F
c段的大部分都水解成較小分子的肽,不呈現任何生物學活性)。
段,還有
F
c段的小部分(此時
F
c段的大部分都水解成較小分子的肽,不呈現任何生物學活性)。
Fc段為 Ig分子中能夠結晶的部分,由兩個1/2重鏈(靠 C端)組成。每類Ig的特異抗原性都由它的Fc段來決定。
生物合成 Ig分子的實質是蛋白質,因而,它的生物合成與一般蛋白質相類似。所不同的隻是一般蛋白質在生物合成時,總是由一個基因決定一條蛋白質的肽鏈,而FIg卻是由兩個基因決定它的一條肽鏈:一個基因決定該肽鏈的恒定區,另一個基因決定該肽鏈的可變區。決定恒定區的基因數目有限,決定可變區的基因數目非常大,這使Ig呈現多樣性(見抗體的多樣性)。
類別與作用 ①IgG:血清中最主要的免疫球蛋白,含量約占Ig總量的80%,正常成人血清中IgG含量為8~16毫克/毫升。大部分在脾臟和淋巴結的漿細胞內合成,積放於血液和組織液中。它是唯一能穿過胎盤的Ig,可保護胎兒和初生兒免受感染。正常人血清中的 IgG可再分為4個亞類:IgG1、IgG2、IgG3和IgG4。它們的氨基酸組成和結構不同,因而具有不同的抗原性和生物學功能。小鼠、大鼠、豚鼠、豬、羊、牛等的IgG都有亞類;②IgA:血清中的含量僅次於 IgG。分為血清型和分泌型兩種。血清型IgA存在於血清中,分泌型IgA存在於粘膜分泌液(如淚液、鼻腔液、唾液、初乳以及氣管、胃腸、生殖泌尿器官的分泌液)中。分泌型 IgA為局部粘膜防禦機制的重要物質,因與局部免疫有密切關系,所以叫“局部抗體”。血清中的IgA有單體(沉淀系數7S)和多聚體(9S、11S、13S)。分泌型IgA多為二聚體(11S),由兩個或兩個以上的單體經連接鏈(J鏈)連接起來。J鏈為一單鏈多肽,富含米胱氨酸,分子量約為2.5萬。在分泌型IgA的分子中,除J鏈外,還有一個分泌片,簡稱SP。它是一種糖蛋白,分子量約為5.8萬,可能有兩種生物學功能,一是使分泌型IgA免受分泌液中某些蛋白質水解酶的水解,二是使IgA易於穿透分泌器官的粘膜進入分泌液。IgA有IgA1和IgA2兩個亞類。兩者的氨基酸組成、二硫鍵位置和抗原性都不相同。在血清中,IgA1約占80%,IgA2約占20%;但在分泌液中,IgA1和IgA2的含量大致相等;③IgM:由5個Ig單體(兩條輕鏈和兩條重鏈)構成,通過J鏈連接成“星形”的五聚體結構(圖1)。分子量最大,所以又稱巨球蛋白。主要存在於血液中,是血細胞、細菌等細胞型抗原誘生的抗體,冷凝集素、類風濕因子、梅素補體結合抗體等都是 IgM。1個IgM分子即可固定補體,因而能溶菌、溶血細胞,也能中和病毒,其作用比IgG約強100倍,所以屬於高效能抗體。IgM是個體發育中最先合成的抗體,因此,檢查IgM有助於傳染病的早期診斷。IgM不能通過胎盤,若臍血中的IgM增高,則表示胚胎期會被感染;④IgD:主要存在於血清中,含量較低,平均每毫升血清中隻有0.03毫升。性質不穩定,易被熱和血液中的蛋白水解酶降解,半衰期很短(2~8日)。IgD存在於一部分臍帶血B細胞表面,可能是B細胞表面的受體。其功能尚不清楚,對青黴素、胰島素、乳蛋白、胞核抗原、甲狀腺抗原等具有抗體活性。此外,在孕婦(特別是妊娠後期)、流行性出血熱患者等的血清中,IgD明顯升高。在自身免疫病中,IgD常是免疫復合物的成分之一;⑤IgE:又稱反應素。在血清中含量極微,平均每毫升僅含0.00033毫克。半衰期最短(2~3日)。IgE是引起I型超敏反應的抗體,因對同種細胞有親嗜性,故有親同種細胞抗體之稱。IgE的Fc段易與皮膚組織,尤其是易與血流中的嗜堿粒細胞、組織中的肥大細胞和血管內的皮細胞結合。抗原與IgE的F
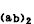 段結合後,
F
c受體則發生變構效應,從而使肥大細胞、嗜堿粒細胞釋放組織胺、5-羥色胺慢反應物質和緩激肽等藥理活性物質引起一系列I型超敏反應癥狀。IgE主要是在呼吸道和腸道淋巴結中合成,然後進入外分泌液和血中。在哮喘和枯草熱患者的鼻液和痰液中以及蠕蟲病患者的血液中,IgE含量均較高。在蕁麻疹、特發性皮炎和血管性水腫等患者的血中,IgE也常有增高現象。
段結合後,
F
c受體則發生變構效應,從而使肥大細胞、嗜堿粒細胞釋放組織胺、5-羥色胺慢反應物質和緩激肽等藥理活性物質引起一系列I型超敏反應癥狀。IgE主要是在呼吸道和腸道淋巴結中合成,然後進入外分泌液和血中。在哮喘和枯草熱患者的鼻液和痰液中以及蠕蟲病患者的血液中,IgE含量均較高。在蕁麻疹、特發性皮炎和血管性水腫等患者的血中,IgE也常有增高現象。
異常免疫球蛋白 ①M成分:氨基酸組成和順序十分均一的異常Ig,可在骨髓瘤、巨球蛋白血癥或惡性淋巴瘤患者的血或尿中出現,為單克隆抗體形成細胞癌變增殖的產物。由於M成分是單克隆的Ig分子,所以其組成和結構十分均一,被廣泛應用於Ig分子的一級、二級和三級結構的研究;②本周蛋白:某些多發性骨髓瘤患者尿中出現一種蛋白。1848年,因由英國醫生H.本斯-瓊斯發現而得名。這種蛋白具有一種特殊的物理性質:將患者尿加熱至60℃左右,蛋白呈絮狀,形成沉淀,繼續加熱至100℃,絮狀沉淀又溶解(一般血漿蛋白加熱到100℃時,絮狀沉淀多結成塊狀),而在冷卻後,絮狀沉淀又出現。百餘年來,一直不解這種蛋白的本質,直至1962年才由美國生物學傢G.M.埃德爾曼闡明:本周蛋白是Ig的輕鏈,主要以輕鏈的二聚體形式存在。由於這種蛋白質的組成十分均一,由單克隆漿細胞產生,又能從尿中提純,因此研究它的組成和結構對於瞭解Ig的組成、結構和功能有很大的幫助。正常人尿中也常有微量本周蛋白存在。