體液中酸鹼度穩定的現象。溶液中能產生H+的溶質稱為酸;能與H+結合的溶質稱為堿。例如在
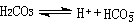 這一反應式中,
H
2
CO
3為酸,
HCO
3
-為堿。體液中的氫離子濃度,即[
H
+],通常用pH來表示,[
H
+]的-log值即為pH。溶液pH<7時為酸性;>7時為堿性;=7時為中性。
這一反應式中,
H
2
CO
3為酸,
HCO
3
-為堿。體液中的氫離子濃度,即[
H
+],通常用pH來表示,[
H
+]的-log值即為pH。溶液pH<7時為酸性;>7時為堿性;=7時為中性。
食物在人體被消化、吸收後經肝臟代謝,可產生大量酸性代謝產物。正常成人每日每千克體重約可產生H+1mmol ,兒童2~3mmol,以70千克體重成人為例,每日約可產H+70mmol,即等於7×107nmol(nM),可使細胞外液(占體重約20%)的[ H+]增加達5×106nmol/L,嚴重影響體液的pH。但實際上在正常生理情況下,機體能使體液的pH維持在7.35~7.45這一狹窄范圍內,即體液[H+]=40±5nmol/L、僅為上述每日產生[H+]的12.5萬分之一。99%以上的H+均通體液中的緩沖物質及肺、腎的調節被中和並被清除。這種使體液pH穩定地保持在正常范圍的現象,即稱酸堿平衡。
體液的正常pH,對人體維持多種生理功能十分重要。例如體內各種生物化學反應所需的酶,都必須在一定pH條件下才能有活性;氧在體內的轉運,血液凝固及肌肉(包括心肌)的收縮……也都要求在此酸堿度范圍內才能正常地進行。而機體是在每日產生及消除大量H+的基礎上來維持體液低水平[H+]的,因此這種平衡極易被破壞。例如呼吸或腎功能發生障礙,胃腸道由於嘔吐丟失大量H+,腹瀉丟失大量HCO3-;代謝異常產生大量有機酸(如乳酸、酮體)時,均可出現酸堿平衡失調,即酸中毒或堿中毒。酸堿失衡將嚴重影響全身各臟器的功能,屬全局性的紊亂,當pH<6.8或>7.8±1時,人體常不能存活。
酸堿平衡的調節 酸堿平衡主要依靠以下三方面的調節:
體液緩沖系統 緩沖系統由弱酸與其鹽類組成(這稱為緩沖對),具有迅速中和酸及堿的雙重作用,可使體液pH不發生顯著升降。人體緩沖系可歸為三類:
①
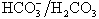 ;②蛋白質
-/H蛋白質(包括血紅蛋白鉀鹽/血紅蛋白);③
;②蛋白質
-/H蛋白質(包括血紅蛋白鉀鹽/血紅蛋白);③
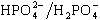 。其中以
。其中以
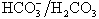 系統最重要,因其緩沖容量較大,且有肺、腎作後盾。血漿、細胞間液、細胞內液及骨質均有各自的緩沖系(見表)。它們各自分擔、互相協同處理酸或堿,最終使各部分體液的pH達到平衡,但這過程需經一定時間。血漿區加入HCl後,30分鐘左右血漿pH才能與細胞間液達平衡;數小時後才能與細胞內液達平衡;骨內平衡需2~3天,故隻在慢性持續性酸堿失衡時才起緩沖作用。雖然細胞間液及細胞內液的緩沖作用較緩慢,但緩沖容量大,細胞間液緩沖容量為血漿的3倍;細胞內液緩沖容量占總體液緩沖容量的50%。
各種體液的緩沖系統
系統最重要,因其緩沖容量較大,且有肺、腎作後盾。血漿、細胞間液、細胞內液及骨質均有各自的緩沖系(見表)。它們各自分擔、互相協同處理酸或堿,最終使各部分體液的pH達到平衡,但這過程需經一定時間。血漿區加入HCl後,30分鐘左右血漿pH才能與細胞間液達平衡;數小時後才能與細胞內液達平衡;骨內平衡需2~3天,故隻在慢性持續性酸堿失衡時才起緩沖作用。雖然細胞間液及細胞內液的緩沖作用較緩慢,但緩沖容量大,細胞間液緩沖容量為血漿的3倍;細胞內液緩沖容量占總體液緩沖容量的50%。
各種體液的緩沖系統

體液的pH與緩沖系統的關系可用亨德森-哈塞爾巴爾赫二氏公式來表示 :
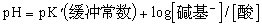
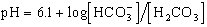
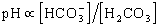
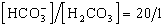
pH=7.4
以碳酸氫鹽緩沖為例說明緩沖機理,當內源或外源的固定酸(碳酸以外的酸)進入體液時,緩沖系HCO3-與之發生反應:
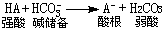 其效應是:①強酸變弱酸,避免pH急劇下降;②消耗瞭堿儲備(
HCO
3
-有緩沖酸的作用,故稱為堿儲備),故二氧化碳結合力下降;③
H
2
CO
3增多;④酸根,如
SO
4
2-,
HPO
4
2-或有機酸根在體內堆積。緩沖系統雖可防止pH急劇下降,但上述四方面影響的消除,尚需肺及腎的調節。同樣,當堿性液進入體液後,
H
2
CO
3與之反應:
其效應是:①強酸變弱酸,避免pH急劇下降;②消耗瞭堿儲備(
HCO
3
-有緩沖酸的作用,故稱為堿儲備),故二氧化碳結合力下降;③
H
2
CO
3增多;④酸根,如
SO
4
2-,
HPO
4
2-或有機酸根在體內堆積。緩沖系統雖可防止pH急劇下降,但上述四方面影響的消除,尚需肺及腎的調節。同樣,當堿性液進入體液後,
H
2
CO
3與之反應:
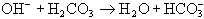 緩沖系統可使強堿變為弱堿,避免pH急劇上升,
H
2
CO
3降低,堿儲備增加,最終需肺與腎予以恢復。
緩沖系統可使強堿變為弱堿,避免pH急劇上升,
H
2
CO
3降低,堿儲備增加,最終需肺與腎予以恢復。
肺的調節 糖和脂肪等在體內氧化後最終雖可產生大量H2CO3,H2CO3又可發生這樣的變化:
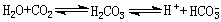 但由於呼吸時不斷排出
CO
2,使上述反應式由右向左進行,使體內的[
H
+]不產生多大影響。
但由於呼吸時不斷排出
CO
2,使上述反應式由右向左進行,使體內的[
H
+]不產生多大影響。
上述固定酸被堿儲備緩沖,pH下降,可刺激呼吸中樞使呼吸加深加快,排出更多CO2,使H2CO3下降(緩沖系統的效應③被消除)、[HCO3-]/[H2CO3]接近正常的20/1 ,pH趨向於正常(①被部分消除)。同理,當代謝性堿中毒時,呼吸受抑,使血中H2CO3升高,以使體液pH接近正常。呼吸代償一般需經8~12小時才能達最大限度。
腎的調節 腎小管細胞可通過排出H+,產生新的
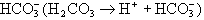 ,以補充被消耗的
HCO
3
-(緩沖系統效應②被消除)。
H
+與由腎小球濾過的酸根結合後,由尿排除(效應④被消除)。腎調節可使pH恢復正常(效應①完全消除),但腎調節較慢,一般需幾天才完成。其具體調節方式如下:
,以補充被消耗的
HCO
3
-(緩沖系統效應②被消除)。
H
+與由腎小球濾過的酸根結合後,由尿排除(效應④被消除)。腎調節可使pH恢復正常(效應①完全消除),但腎調節較慢,一般需幾天才完成。其具體調節方式如下:
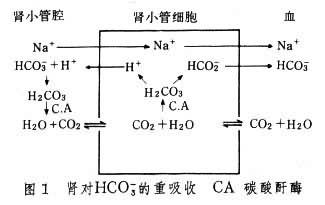
①HCL3-重吸收。由腎小球濾過的HCO3-,幾乎全部再由腎小管吸收,回吸80~90%位於近端腎小管。這一過程並未增加體液堿儲備,也不影響其pH。堿中毒時,血漿HCO3-增加,尿中NaHCO3排出增加,使體液 pH下降(圖1)。
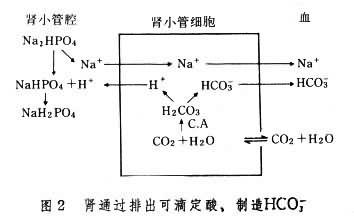
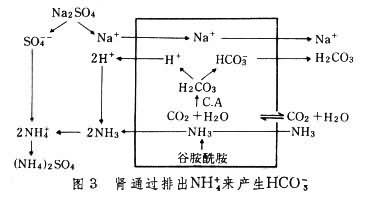
②H+的排泌。主要通過遠端腎小管,其方式有二:一為被腎小球過濾的Na2HPO4與腎小管排泌的H+結合,以弱酸NaH2PO4的形式由尿排出(圖2)。二為腎小管細胞分解谷氨酰胺而產生NH3,NH3可擴散至腎小管腔與腎排泌的H+結合,形成NH4+,NH4+與被腎小球過濾的酸根結合,形成銨鹽由尿排出(圖3)。