兩種或兩種以上不同電極電位的金屬處於腐蝕介質內相互接觸而引起的電化學腐蝕,又稱接觸腐蝕或雙金屬腐蝕。電偶腐蝕原理見圖1。發生電偶腐蝕時,電極電位較負的金屬通常會加速腐蝕,而電極電位較正的金屬的腐蝕則會減慢(見金屬腐蝕)。

合金中呈現不同電極電位的金屬相、化合物、組分元素的貧化或富集區,以及氧化膜等也都可能與金屬間發生電偶現象,鈍化與濃差效應也會形成電偶型的腐蝕現象,這些微區中的電偶現象通常稱為腐蝕微電池,不稱作電偶腐蝕。
根據電化學理論可以對電偶腐蝕現象作定性判斷,但對腐蝕的結果還難以作出動力學分析。各種常見的金屬或合金在某些腐蝕介質內的標準電極電位雖已充分瞭解,但還不能由此確定電偶腐蝕的速度及其結果的實際圖像,也就是還不能從電偶中不同金屬的可逆電極電位之差直接得到各部位電偶腐蝕速度的定量關系。在工程設計中,往往需要結合在實際介質中的腐蝕電位和可能掌握的極化曲線特征作出判斷,並作必要的實際測定和驗證。在腐蝕過程中,隨著條件的變化,金屬的電偶序有可能發生變化,甚至出現極性倒轉。此外,電偶腐蝕的結果也直接與電極的面積大小有關。
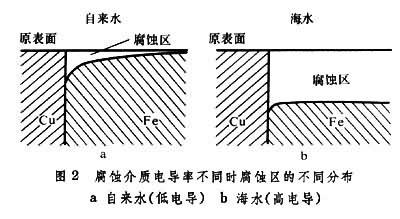
影響電偶腐蝕速度的因素主要有:①所形成的電偶間的電極電位差;②腐蝕介質的電導(圖2);③金屬表面的極化和由於陰、陽極反應生成表面膜或腐蝕產物的影響;④電偶間的空間佈置(幾何因素)。電偶腐蝕速度,在數量上服從法拉第電解定律。兩金屬之間的電極電位差愈大、電流愈大,則腐蝕愈快。電路中的各種電阻則按歐姆定律影響電偶腐蝕電流,介質的電導率高,則加速電偶腐蝕(見水溶液電解、電勢-pH圖)。
電偶作用有時也會促進陰極的破壞,如等面積的鋁(陰極)和鎂(陽極)在海水中,電偶作用將加速鎂陽極的腐蝕,而在充氣條件下陰極表面上的主要產物OH-也會同時促進鋁的破壞,所以電偶中的兩極最終都會加劇腐蝕。
電偶腐蝕的主要防止措施有:①選擇在工作環境下電極電位盡量接近(最好不超過50毫伏)的金屬作為相接觸的電偶對;②減小較正電極電位金屬的面積,盡量使電極電位較負的金屬表面積增大;③盡量使相接觸的金屬電絕緣,並使介質電阻增大;④充分利用防護層,或設法外加保護電位。選擇防護方法時應考慮面積律的影響,以及腐蝕產物的影響等。