由熱力學第二定律所確定的熱力狀態參數,以S表示,單位J/K。熵是弧立系統(見熱力系統)自發改變狀態的可能性的量度,改變後熵增越大的狀態,改變的可能性越大。熵的微分定義是:系統在可逆過程中同外界交換的熱量與系統熱力學溫度的比值
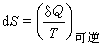
或
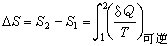 單位質量的熵叫比熵。比熵
單位質量的熵叫比熵。比熵
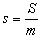 ,單位J/(kg·K)。
,單位J/(kg·K)。
對於可逆過程,系統吸熱時熵增加,放熱時熵減少,絕熱時熵不變(定熵過程)。工程上常用溫-熵圖(T-S圖)分析計算熱力過程和熱力循環。圖中1-2過程線下方的面積122′1′為系統經歷該可逆過程時與外界交換的熱量。
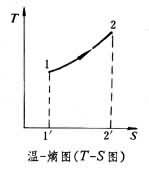 溫-熵圖
溫-熵圖
對於不可逆過程,由熱力學第二定律可得出不等式
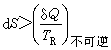
或
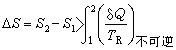 式中
T
R為熱源溫度(對於可逆過程,熱源溫度與系統的溫度相等)。
式中
T
R為熱源溫度(對於可逆過程,熱源溫度與系統的溫度相等)。
弧立系統與外界無熱量交換,在可逆過程中其熵不變;在不可逆過程中其熵恒增。因此弧立系統的熵永遠不會減少,這稱為弧立系統熵增原理。一切實際過程都是向著使弧立系統熵增的方向進行的。
弧立系統的熵增是過程不可逆性引起的作功能力損失的一種度量。作功能力的損失△W1等於弧立系統熵增ΔS與環境的熱力學溫度To的乘積
△W1=To·△S
弧立系統熵增越大,作功能力損失也越多。
從微觀上看,系統的熵與熱力學概率Ω(系統在某宏觀狀態下所有可能的微觀狀態的總數)有關,即
S=klnΩ
式中k為玻耳茲曼常數。弧立系統內一切過程總是朝著由熱力學概率小的狀態(有序態)到熱力學概率大的狀態(無序態)的方向進行。