描寫熱力狀態的物理量,簡稱狀態參數。熱力學中常用的狀態參數有壓力、比容、溫度、內能、焓、熵、亥姆霍茲函數和吉佈斯函數等。
壓力 單位面積上承受的垂直作用力,以符號p表示。壓力測量儀錶通常處於大氣環境中,因此儀錶指示的並非氣體的真實壓力而是它與大氣壓力
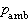 的差值。氣體的真實壓力稱為絕對壓力。當絕對壓力高於大氣壓力時,壓力測量儀表所指示的是絕對壓力超出大氣壓力的部分,稱為表壓力(
p
0):
p
0=
p-
的差值。氣體的真實壓力稱為絕對壓力。當絕對壓力高於大氣壓力時,壓力測量儀表所指示的是絕對壓力超出大氣壓力的部分,稱為表壓力(
p
0):
p
0=
p-
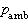 。當氣體的絕對壓力低於大氣壓力時,真空計所指示的是絕對壓力低於大氣壓力的部分,稱為真空度(
p
v):
p
v=
。當氣體的絕對壓力低於大氣壓力時,真空計所指示的是絕對壓力低於大氣壓力的部分,稱為真空度(
p
v):
p
v=
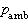 -
p。在國際單位制中,壓力的單位是帕〔Pa〕。
-
p。在國際單位制中,壓力的單位是帕〔Pa〕。
比容 單位質量物質所占有的容積。若m質量的物質占有V容積,則比容為:v=V/m。比容的倒數稱為密度
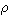 ,是單位容積的物質所具有的質量,即
,是單位容積的物質所具有的質量,即
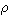 =
m/
V=1/
v。
=
m/
V=1/
v。
溫度 表示物體的冷熱程度。熱力學中的溫度是衡量一個熱力系統是否與其他熱力系統處於熱平衡的標志,一切處於熱平衡的系統都具有相同的溫度。對於氣體,溫度是大量氣體分子平均移動動能的量度,即
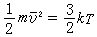 式中
m為分子的質量;
v為分子平移均方根速度;
k為玻耳茲曼常數;
T為熱力學溫度。
式中
m為分子的質量;
v為分子平移均方根速度;
k為玻耳茲曼常數;
T為熱力學溫度。
溫度的數值表示法,稱為溫度標尺或"溫標"。在國際單位制中采用熱力學溫標,也就是采用開爾文溫標或絕對溫標,用符號T表示,單位是K。規定水的三相點(冰、水、汽三相平衡共存時的狀態)為273.16K,每1K的間隔為水的三相點熱力學溫度的1/273.16。此外,常用的還有攝氏溫標和華氏溫標。攝氏溫標符號為t,定義為
t(℃)=T(K)-273.15
攝氏溫標的單位是攝氏度,符號℃,其每度間隔與熱力學溫標的相同。華氏溫標t則將水在1標準大氣壓(101325帕)時的冰點和汽點分別定為32度和212度,中間為180分度,單位是
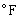 ,它與攝氏溫標之間的換算關系為
,它與攝氏溫標之間的換算關系為
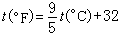 用華氏溫標表示的熱力學溫標稱為蘭金溫標(Rankine scale)或稱熱力學華氏溫標,也用符號
T表示,單位是
用華氏溫標表示的熱力學溫標稱為蘭金溫標(Rankine scale)或稱熱力學華氏溫標,也用符號
T表示,單位是
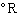 ,它們之間的換算關系為
,它們之間的換算關系為
T(
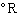 )=
t(
)=
t(
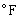 )+459.
67
)+459.
67
內能 從微觀看,內能是指組成熱力系統的大量粒子本身所具有的能量,包括分子的動能、位能、化學能和原子的核能等。在發生物理變化時,物質的分子和原子內部結構都不發生變化,化學能與原子的核能可以不必考慮。這時可以用p、v、T中的任意兩個狀態參數來確定它的狀態。對於理想氣體,內能隻與溫度有關。單位質量的內能稱為比內能。內能和比內能分別用符號U、u表示。
焓 焓的定義式為
H=U+pV
焓的單位為焦耳(J)。單位物質的焓稱為比焓,它表示為
h=u+pv
比焓的單位為焦每千克(J/kg)。
熵 熵的微分定義式為
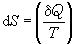 它表示系統的熵增等於在可逆過程中該系統與外界交換的熱量δ
Q同系統的熱力學溫度
T的比值。式中
S為熱力系統的熵(J/K),它是由
熱力學第二定律導出的狀態參數。單位質量的熵稱為比熵,單位為焦每千克開〔J/(kg·K)〕,它表示為熵除以質量,即
s=
S/
m。
它表示系統的熵增等於在可逆過程中該系統與外界交換的熱量δ
Q同系統的熱力學溫度
T的比值。式中
S為熱力系統的熵(J/K),它是由
熱力學第二定律導出的狀態參數。單位質量的熵稱為比熵,單位為焦每千克開〔J/(kg·K)〕,它表示為熵除以質量,即
s=
S/
m。
亥姆霍茲函數 又稱亥姆霍茲自由能或定溫-定容位,定義式為:F=U-TS。單位質量的亥姆霍茲函數定義為:f=u-Ts。是定溫-定容條件下,可利用熱力系統F(或f)值的變化來判斷過程自發進行的方向和限度。
吉佈斯函數 又稱吉佈斯自由能或定溫-定壓位,定義式為:G=H-TS。單位質量的吉佈斯函數定義為:g=h-Ts。在定溫-定壓條件下,可利用熱力系統G(或g)值的變化來判斷過程自發進行的方向和限度。