熱力學的基本定律之一,通常表述為:無論用什麼方法,靠有限步驟不可能使系統達到絕對溫度零度。1906年,德國化學傢W.H.能斯脫首先提出“熱定理”,1912年,經M.普朗克、F.E.西蒙、G.N.路易士等人的發展,形成熱力學第三定律的又一種表述,即能斯脫-西蒙表述:當絕對溫度T趨近零度時,凝聚系發生可逆等溫過程,其熵S的變化趨近於零,即
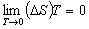
式中(ΔS)T為可逆等溫過程中熵的變化。以上兩種表述是完全一致的,違反任一種表述,必然違反另一種表述,熱力學第三定律反映瞭絕對零度及其鄰近區域的熱現象的規律性。根據能斯脫-西蒙表述,處在T=0K和熱力平衡時,一個凝聚系的熵具有確定的數值,不論是否發生化學反應都不會引起熵的變化,因此它是一個絕對常數。1911年,普朗克假設當絕對溫度為零度時,一切物質在平衡時的熵均為零。據此可以確定各種元素和化合物在某一狀態熵的絕對值(絕對熵),它為計算燃料燃燒和化學反應平衡等所必需。這是第三定律的一個重要用途。由第三定律還可得出:當絕對溫度趨近於零度時,凝聚物質的熱容量趨近於零,熱膨脹系數趨近於零,彈性系數趨近於零。熱力學第三定律的各種表述及其推論都是從對平衡態或與平衡有關的過程研究得出的。一個未達到熱力平衡的系統,在絕對溫度零度時的熵值不等於零。