利用電化學手段分離溶液中的金屬離子、有機分子的方法,共分四類:
控制電位的電解分離法 當溶液中存在兩種或兩種以上的金屬離子時,如果它們的還原電位相近,例如Cu2+(標準電極電位E°=+0.345伏)和Bi3+(EE°=+0.2伏),則在電解時都會還原析出,達不到分離的目的。圖1表示,
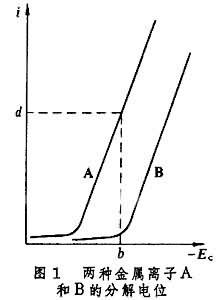 如果控制陰極電位為
b,則金屬離子A可產生強度為
d的電流,即可被還原;而金屬離子B的電流強度極小,即幾乎不能被還原,這樣即可達到分離目的,並分別測定A和B。
如果控制陰極電位為
b,則金屬離子A可產生強度為
d的電流,即可被還原;而金屬離子B的電流強度極小,即幾乎不能被還原,這樣即可達到分離目的,並分別測定A和B。
在電解過程中,陰極電位Ec是在不斷變化的:
Ec=
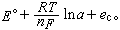
式中E°為標準電極電位;R為氣體常數;T為熱力學溫度;n為電極過程電子轉移數;F為法拉第常數;a為離子活度;ec為陰極超電壓。電解時,離子濃度不斷降低,Ec的負值不斷增加,以致B也被電解出來。
為瞭控制陰極電位,要用圖2
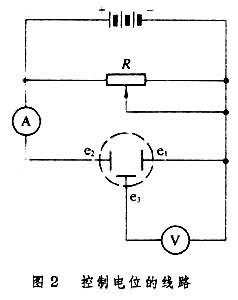 的線路隨時調整外加電壓。圖中
e
1是鉑網陰極,
e
2是鉑絲對電極,
e
3是參比電極(飽和甘汞電極)。選定的
e
1的電位(相對於
e
3)可從電位計V讀出,電解電流從毫安計 A讀出,在電解過程中不斷調整電阻
R以保持陰極電位不變。
的線路隨時調整外加電壓。圖中
e
1是鉑網陰極,
e
2是鉑絲對電極,
e
3是參比電極(飽和甘汞電極)。選定的
e
1的電位(相對於
e
3)可從電位計V讀出,電解電流從毫安計 A讀出,在電解過程中不斷調整電阻
R以保持陰極電位不變。
至於選擇什麼電位要看實驗條件,例如在分別測定Cu2+和Bi3+時,由於兩者電位太相近,需要在溶液中加入酒石酸,調節pH=5.8~6.0,Bi3+與酒石酸生成的絡合物比Cu2+的穩定得多,使兩者的分解電壓相差得大一些,然後再加入適量的肼,以加速Cu2+的還原。在這種條件下,控制陰極電位為-0.30伏,銅先電解出來,稱出陰極的增重後,調節pH為4.5~5.5,控制陰極電位為-0.40伏,可將鉍全部電解出來。如果溶液中還有Pb2+,可將電位控制在-0.50伏,進行電解。應用此法時,後被電解的離子的濃度不能超過先被電解的離子的濃度。
汞陰極電解分離法 H+在汞陰極上被還原時,有很大的超電壓,所以在酸性溶液中可以分離掉一些容易被還原的金屬離子,使一些重金屬(如銅、鉛、鎘、鋅)沉積在汞陰極上,形成汞齊,同時保留少量不容易被還原的離子,如堿金屬、堿土金屬、鋁、鐵、鎳、鉻、鈦、釩、鎢、矽等。
利用圖3
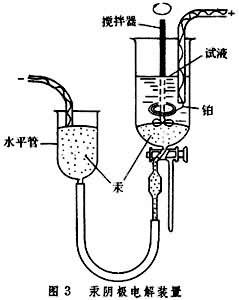 的裝置可以進行電解分離,棄去汞陰極中的重金屬,溶液中的離子可用其他方法測定。如果要測定殘留在汞中的微量金屬,可將汞蒸去,再用其他方法測定金屬。但本法主要用於分離金屬離子。
的裝置可以進行電解分離,棄去汞陰極中的重金屬,溶液中的離子可用其他方法測定。如果要測定殘留在汞中的微量金屬,可將汞蒸去,再用其他方法測定金屬。但本法主要用於分離金屬離子。
內電解分離法 在酸性溶液中,利用金屬氧化-還原電位的不同,可以組成一個內電解池,即不需要外加電壓就可以進行電解。例如要從大量鉛中分離微量銅,在硫酸溶液中Cu2+比Pb2+先還原,因此可將鉛板作為一個電極,與鉑電極相連,組成一個內電解池,它產生一個自發的電動勢,來源於Pb的氧化和Cu2+的還原。這個電動勢使反應能夠進行,直到電流趨近於零時,內電解池就不再作用瞭。內電解可以分離出微量的容易還原的金屬離子,缺點是電解進行緩慢,因此應用不廣。
電滲析法 液體中的離子或荷電質點能在電場的影響下遷移。由於離子的性質不同,遷移的速率也不同,正負電荷移動的方向也不同。當在電池的兩極加上一個直流電壓時,可以把一些有機物的混合物分離。如臨床實驗中常用此法研究蛋白質,將試樣放在一個載器上,外加電場後,荷電質點沿著載器向電荷相反的電極遷移,因它們移動的速率不同而分離,一般能把血清蛋白分成五部分。改進實驗技術可使濃縮斑點的寬度達到25微米左右,然後進行電滲析,可將血清蛋白分成二十個很清晰的部分。