胎體與母體之間進行物質交換的重要器官,妊娠過程中於母體子宮內形成。是胎體與母體組織的結合體,由羊膜、葉狀絨毛膜及底蛻膜構成。是胎兒附屬物(胎兒體外的組織)之一。胎盤的異常和疾病會影響胎兒的發育,或引起流產、早產、胎盤早期剝離、產後出血等產科疾病。
胎盤的形成 胎盤是囊胚植入子宮後逐漸形成的。
滋養層發育< 受精後6~8天,囊胚植入子宮內膜時,滋養層(見妊娠)迅速增生,細胞分化成內、外兩層,外層為合體細胞層,內層為朗格漢斯氏細胞層。
絨毛及絨毛膜 受精後約12天,滋養層表面可見到由合體細胞聚集成的小突起,其中有一個實體的朗格漢斯氏細胞核心,突起又分許多小支而成絨毛。初級絨毛中無血管,滋養層細胞從蛻膜直接吸收營養,這稱為原始絨毛。絨毛中間的間質有血管形成,約在受精後3周,絨毛血管與胚胎體蒂中的血管相連,形成完整的胎體循環通路。最初滋養層表面佈滿絨毛,形同毛栗。4個月時隻有與底蛻膜接觸的絨毛,因營養來源豐富而高度發展,稱葉狀絨毛膜,其餘絨毛因缺血,萎縮退化成平滑絨毛膜。葉狀絨毛膜大部分絨毛末端浮懸於充滿母血的絨毛間隙中,稱遊離絨毛,是母兒物質交換的主要渠道;少數絨毛與底蛻膜融合,起固定作用,稱固定絨毛。
蛻膜形成 孕卵著床後,子宮內膜受孕激素的影響,變得血管豐富,間質疏松、水腫,腺體更加彎曲並含豐富的分泌物,這種子宮內膜稱為蛻膜。蛻膜分成三部分:底蛻膜(受精卵下方的部分)、包蛻膜(覆蓋於受精卵上面)及真蛻膜(其餘覆蓋於子宮腔內的蛻膜)(圖1)。
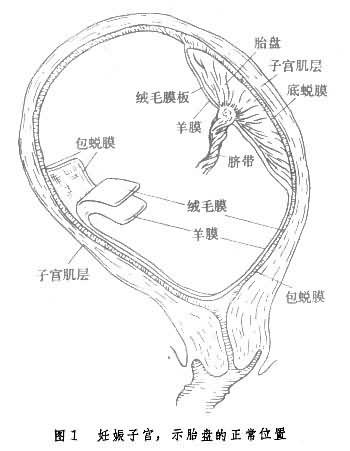
胎盤形成 足月胎盤重500~600克,約為新生兒體重的1/6,胎盤直徑約18~20cm,厚約2.5cm,分母體面與子面。母體面由蛻膜隔分成18~20個胎盤小葉,直接與子宮內膜(蛻膜)接觸。子面被羊膜覆蓋,表面光滑。臍帶附著於胎盤子面中央或邊側,臍帶動、靜脈從臍帶附著點分枝向四周呈放射狀分佈,直達胎盤邊緣,有分支穿過絨毛膜板進入絨毛幹及其分支。
羊膜 兩胚層時期胚胎的外胚層空間稱羊膜腔,在胚板上面。後羊膜腔隨胚胎發育而漸漸增大,包圍胚胎,並與絨毛膜緊貼,將胚外體腔封團。在胎盤處羊膜成為其胎兒面。羊膜又包裹體蒂、尿囊、卵黃囊而形成臍帶。
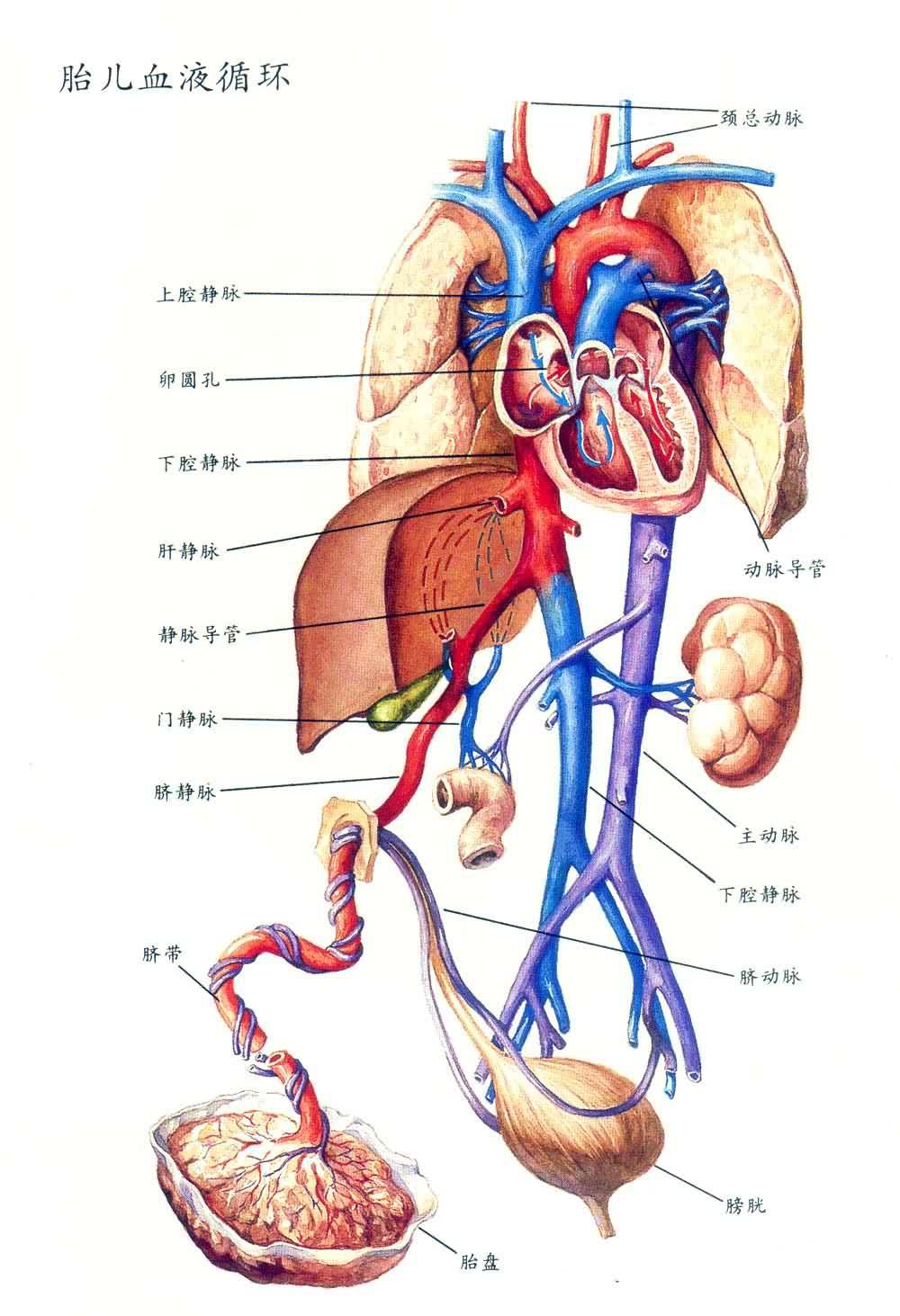
胎盤血液循環 包括胎兒與母體完全分開的兩套循環通路、胎盤的絨毛間隙中充滿母血,絨毛浴在母血中。母體動脈血進入絨毛間隙,母兒組織通過絨毛合體細胞進行物質交換,但母血與兒血不直接相通(圖2)。
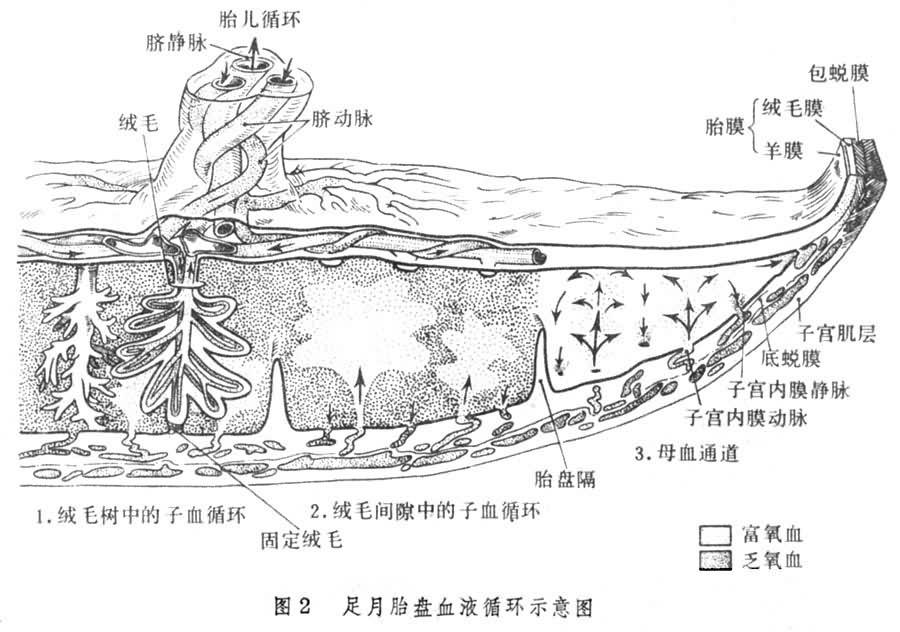
母血循環 子宮動脈分支為子宮內膜螺旋小動脈,穿過蛻膜板(胎盤靠母體面的部分,由蛻膜的致密層組成),進入絨毛間隙,動脈血呈噴射性沖出,向四周擴散,緩慢地流過絨毛間隙(在此與胎兒血交換),絨毛間隙的血液又回到蛻膜板的靜脈中。
胎兒循環 氧分壓較低的胎兒血通過兩條臍動脈帶到胎盤,而氧分壓較高的母血則從胎盤經臍靜脈回到胎兒。每個絨毛分支中都有臍動脈和臍靜脈的分支,絨毛末端有毛細血管。
由此可見母血與胎血並不直接相通,而是隔著絨毛中的血管壁、絨毛間質及絨毛的上皮細胞。如果孕母患有妊娠高血壓綜合征,全身小動脈痙攣,則胎盤血管也有痙攣,這將直接影響胎兒的生長發育。又若孕母缺氧,對胎兒氧的供給也受影響,會造成胎兒在子宮內乏氧(胎兒宮內窒息)。但新生兒ABO溶血現象表明少數胎兒的細胞能進入母血,反之,母血中的一些藥物也能通過胎盤進入胎兒血液循環。
胎盤功能 胎盤不隻是母兒進行物質交換的重要場所,也是一個重要的內分泌器官,有著極其復雜的生理功能。
運輸功能 通過單純擴散、加速擴散和主動運輸三種方式,進行母兒間的氣體交換,供給胎兒營養物質及排出胎兒體內的代謝產物。
屏障功能 過去認為胎盤可以攔阻許多有害於胎兒的物質,使之不能通過,實際上,這種屏障作用極為有限,如結核菌、瘧原蟲可以在胎盤形成病灶,破壞絨毛結構,進入胎體感染胎兒。流感、風疹、水痘等病毒及常用的鎮靜藥、鎮痛藥、吸入麻醉藥或抗生素等藥物,都可透過胎盤進入胎兒血液引起胎兒感染、中毒甚至致畸。此外,一些免疫球蛋白如IgG可通過胎盤,使胎兒從母體獲得抗體,因此胎兒出生後在短時間內具有一定的免疫能力。
免疫功能 妊娠類似異體移植,但胎兒作為移植抗原,母體對之並不排斥,胎兒、胎盤可以繼續存活。這可能是母體對胎兒組織發生免疫耐受的結果。現已證實,從胎兒、胎盤來的抗原到達母體免疫中樞後,母體對此抗原產生免疫排斥,同時也產生免疫封阻,而在這兩種反應中,免疫封阻是主要的,實驗亦證明瞭孕婦血清中存在免疫抑制因子。通過電鏡觀察,滋養層細胞與母體蛻膜細胞之間的隔離並不絕對完整,在臨床上屢見母體細胞或胎兒細胞進入對方循環,這說明胎盤並不能完全起到機械性的屏障作用。
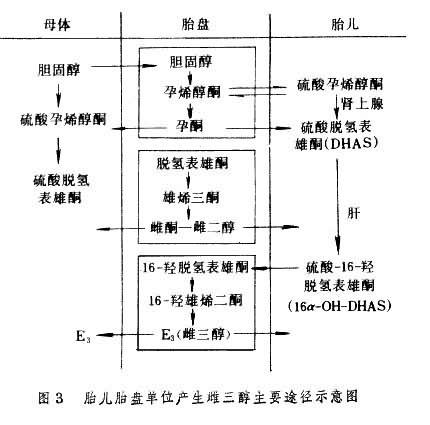
合成功能 胎盤具有活躍的合成蛋白質的能力,可以合成多種激素和酶:①蛋白質激素,絨毛膜促性腺激素是一種糖蛋白,由合體滋養細胞層分泌。孕卵自著床後即開始分泌,為水溶性,易被吸收至母體,受精後10天左右即可用放射免疫法自母體血漿中測出,孕7~8周達高峰,孕10~12周逐漸下降,以後一直以低水平維持至分娩,主要功能是維持妊娠黃體。臨床上用測定血、尿中人絨毛膜促性腺激素 (hCG)以診斷早期妊娠及宮外孕、流產和滋養葉疾患等與妊娠有關的疾病。胎盤催乳素 (hPL)為不含糖分子的單純蛋白質,與人體生長激素類似,由合體滋養細胞層產生以後進入母體循環,以後隨妊娠進展和胎盤增大,分泌量持續增加至妊娠末期。主要功能是促進母體乳腺發育,保證胎兒對葡萄糖及氨基酸的需要,促進胎兒發育。妊娠晚期胎盤功能不足時,hPL濃度下降,故臨床測定血清中 hPL含量以瞭解胎盤功能。②類固醇激素:包括雌激素、孕激素。胎盤可產生大量雌激素。與非妊娠時不同,妊娠期雌激素主要來源於始盤胎兒單位,並以雌三醇E3為主(圖3)。胎盤合成雌激素的前體來自母兒血漿。孕婦血、尿中E3不成比例的升高(尿E3顯著增高)是由於硫酸16-羥脫氫表雄酮自胎兒腎上腺產生而至胎盤合成E3,故臨床測定E3可以說明胎兒胎盤單位的功能。E3在妊娠早、中期緩慢上升,孕36周快速上升,產後突然下降。E3排泄值正常說明胎兒腎上腺分泌功能和肝功能正常,胎盤血循環正常,產母腎功能正常。胎盤血供不足,血管病變及母腎功能不良、胎兒腎上腺分泌異常(無腦兒、胎兒宮內窒息)均可影響 E3排泄。孕激素來源於母體的膽固醇及孕烯醇酮,由胎盤合成,作用是與雌激素共同維持妊娠,並參與妊娠期母體各系統的生理變化。
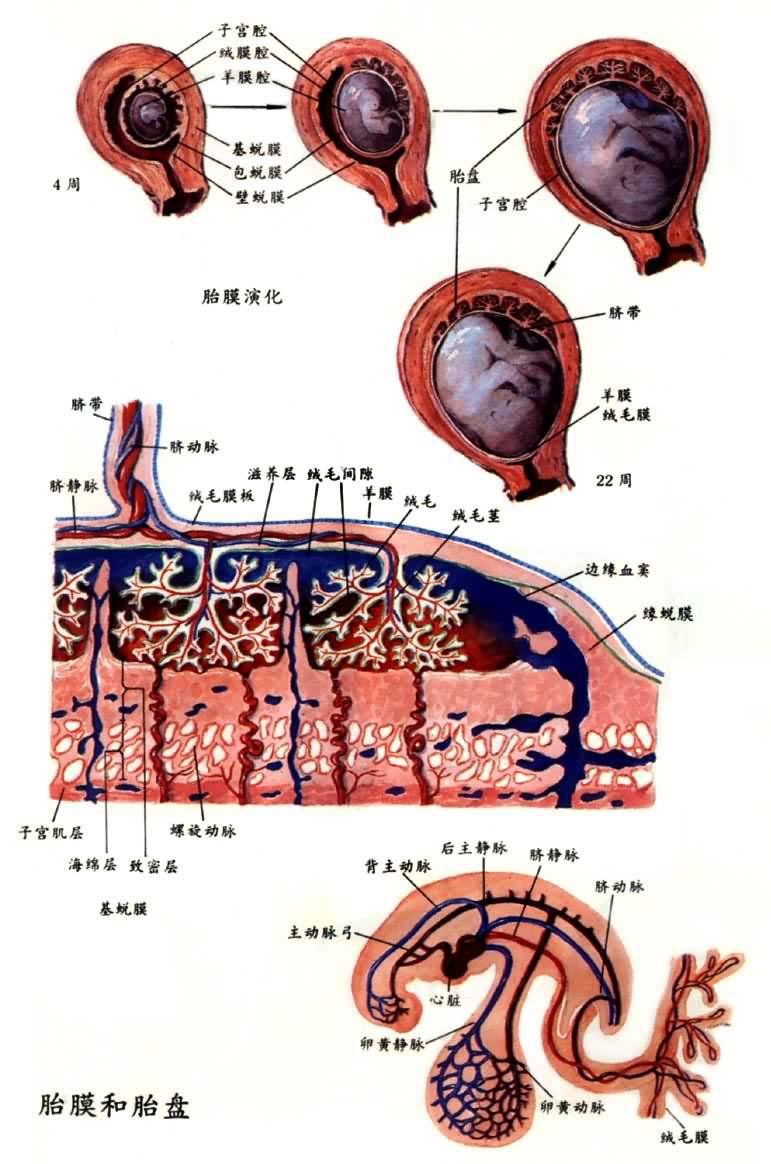 胎膜和胎盤
胎膜和胎盤
胎盤的異常及疾病 包括形態、位置、愈著、剝離等方面的異常。
前置胎盤 胎盤的正常附著處在子宮體的前壁,後壁或側壁,如果胎盤附著於子宮下段或覆蓋於子宮頸內口處,位置低於胎兒的先露部,則可引起晚期妊娠出血(見前置胎盤)。
胎盤早期剝離 妊娠20周後或分娩期胎兒尚未娩出前正常位置的胎盤即部分或全部自子宮壁剝離,是妊娠後期嚴重的並發癥(見胎盤早期剝離)。
形態異常 如心形、腎形、馬蹄形胎盤,膜狀胎盤,有窗樣胎盤,雙葉或多葉胎盤。副胎盤指在正常大小胎盤附近並以血管與之相連的小塊胎盤組織,會滯留宮腔內而致產後出血。
 胎兒血液循環
胎兒血液循環
發育異常 如有緣胎盤、輪廓胎盤。
愈著異常 如粘連胎盤、植入性胎盤,可影響胎盤的剝離,造成產後出血。
胎盤梗塞 若過於廣泛可影響胎兒發育。
胎盤腫瘤 如胎盤囊腫、絨毛膜血管瘤,臨床意義不大。