在嚴重感染、敗血癥、嚴重創傷、大手術、大面積燒傷、長時間心肺復蘇術及病理產科等情況24小時後出現的2個或2個以上系統、器官的功能不全及衰竭的綜合征。不包括上述各疾病發病後24小時內死亡者,亦不同於慢性病瀕死前的全身衰竭。受損系統和器官主要包括肺、腎、肝、胃腸道、心血管、血液、免疫及中樞神經等。受損系統、器官數目與疾病嚴重程度相關。常序貫發生,但亦可數個系統、器官呈暴發性同時衰竭。MSOF早期臨床癥征常為嚴重的原發病所掩蓋,難以識別。一旦確認,多已進入晚期,,組織細胞多已遭受嚴重破壞。MSOF相對多見,且有逐年增多趨勢。發病率在急診大手術後約為8~22%,腹腔膿腫伴敗血癥者高達30~50%。病死率極高。對MSOF高危病人應進行嚴密監測,以做到早發現、早治療。中國大量基礎及臨床研究證實中西醫結合治療的效果明顯優於單純中醫或西醫治療。
歷史回顧及MSOF研究對醫學進步的推動作用MSOF是1970年代醫學科學不斷發展、進步,延長瞭危重病患者存活時間之後出現的一個新課題。50年代,部分嚴重創傷患者渡過瞭休克,但又發生和(或)死於急性腎功能衰竭(ARF)。這個新課題推動瞭對ARF的深入研究及血液透析技術的開展;60年代,成人呼吸窘迫綜合征(ARDS)成為創傷、感染、休克等的嚴重繼發病和主要致死原因,導致對ARDS的深入研究及帶動人工機械通氣機的發展與完善。其後人們認識到上述各單一器官衰竭,實質上是機體對嚴重創傷、感染等多種致病因素侵襲的階段性表現。1973年N.L.蒂爾尼等首先描述瞭本綜合征,稱之為序貫性系統衰竭。其後報告逐年增多。
由於MSOF是由多病因引起的跨學科、跨專業的復雜疾病過程,故分工過細的任何一個專科都不能從整體上掌握這類病人搶救的全面知識和技能。而由多學科、多專業醫護人員臨時組成的集體會診式的搶救組同樣亦存在著缺少能對患者進行全面分析、統一處理的條件。這也就促進瞭危重病急救醫學的迅速發展。
發病原因 包括三個方面。①感染:由敗血癥、腹腔膿腫、腸道功能紊亂及菌群紊亂、細菌遷移等引起。②組織損傷和(或)壞死:創傷、大手術、大面積深度燒傷及病理產科等。③缺血、缺氧:休克、復蘇後綜合征等。研究證實老年人的臟器多處於衰竭臨界狀態許多並不嚴重的應激誘因即可導致MSOF。
發病機制 包括六個方面。
① 炎癥反應:致病微生物及其毒素除直接損傷細胞外,主要通過內源性介質的釋放引起全身炎癥反應;有些嚴重創傷、燒傷病人雖無感染證據,但亦出現全身炎癥反應,其表現與敗血癥引起者同(稱為無菌性敗血癥)。研究表明由機體內源性介質引起的嚴重全身性炎癥反應是MSOF發生、發展的最終共同途徑。
② 活性氧:指超氧化物陰離子(O
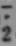 )、羥自由基(OH˙)、過氧化氫(
H
2
O
2)和單線態氧(
1
O
2)。其中
O
)、羥自由基(OH˙)、過氧化氫(
H
2
O
2)和單線態氧(
1
O
2)。其中
O
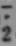 及OH˙為氧自由基,活性氧是一組化學性質極為活潑的、外層軌道上有一個不配對電子的化學物質。活性氧產生過多或清除不足,均可損害組織細胞,是導致MSOF的重要毒性介質。
及OH˙為氧自由基,活性氧是一組化學性質極為活潑的、外層軌道上有一個不配對電子的化學物質。活性氧產生過多或清除不足,均可損害組織細胞,是導致MSOF的重要毒性介質。
正常情況下,進入機體的氧通過線粒體內的電子傳遞,接受4個電子被還原為水。同時發生氧化磷酸化生成 ATP。其中約1~2%的氧通過單價還原(接受一個電子)生成O
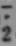 。後者可通過超氧化物歧化酶 (SOD)的作用轉變為
H
2
O
2而清除。若機體 SOD不足,
O
。後者可通過超氧化物歧化酶 (SOD)的作用轉變為
H
2
O
2而清除。若機體 SOD不足,
O
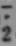 可逐次接受電子成為OH。氧的單價還原過程又稱線粒體內呼吸鏈氧自由基泄漏。
可逐次接受電子成為OH。氧的單價還原過程又稱線粒體內呼吸鏈氧自由基泄漏。
MSOF發病過程中氧自由基增多的原因有線粒體內呼吸鏈氧自由基泄漏(休克、創傷等造成組織缺氧,線粒體呼吸功能降低。恢復血液灌註後,由於細胞色素氧化酶尚未恢復,進入機體的氧未能充分獲得電子成為水及產生 ATP,結果使線粒體內呼吸鏈自由基泄漏增多。同時由於 SOD受損,導致氧自由基增多);中性粒細胞激活(出現“呼吸爆發”產生大量O
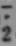 及
1
O
2);次黃嘌呤氧化(組織缺氧,ATP大量分解,依次成為AMP、腺嘌呤、次黃嘌呤核苷及次黃嘌呤。恢復血供後,次黃嘌呤在黃嘌呤氧化酶作用下轉變為尿酸,同時生成O
及
1
O
2);次黃嘌呤氧化(組織缺氧,ATP大量分解,依次成為AMP、腺嘌呤、次黃嘌呤核苷及次黃嘌呤。恢復血供後,次黃嘌呤在黃嘌呤氧化酶作用下轉變為尿酸,同時生成O
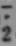 );活性氧清除系統活性下降(機體存在強大的清除活性氧物質,以保護機體細胞免遭活性氧破壞,如超氧化物歧化酶、過氧化氫酶、還原形谷胱甘肽、谷胱甘肽過氧化物酶、氧化型谷肽甘肽嚴重感染、缺氧等多種情況均可使上述清除物質生成不足和(或)被大量消耗,以致機體固有的清除活性氧的能力降低);花生四烯酸代謝過程中產生自由基中間物。
);活性氧清除系統活性下降(機體存在強大的清除活性氧物質,以保護機體細胞免遭活性氧破壞,如超氧化物歧化酶、過氧化氫酶、還原形谷胱甘肽、谷胱甘肽過氧化物酶、氧化型谷肽甘肽嚴重感染、缺氧等多種情況均可使上述清除物質生成不足和(或)被大量消耗,以致機體固有的清除活性氧的能力降低);花生四烯酸代謝過程中產生自由基中間物。
③ 細胞壁花生四烯酸遊離衍生的毒性介質:花生四烯酸(AA)是細胞膜磷脂的主要組成成分。缺血、缺氧、再灌註後,細胞外液中的Ca2+因能量不足,進入細胞內,使細胞膜中的鈣依賴的磷酯酶A2激活,經一系列變化生成多種活性介質,如前列腺素、白三烯、過氧化氫花生四烯酸、羥-20-碳四烯酸、血栓素、前列環素、導致細胞損害。
④ 氧供需及能量代謝紊亂:MSOF的初期反應是代償性交感神經系統興奮增強。機體呈高代謝狀態。氧攝取和氧耗增大。但這些患者卻往往合並不同原因的組織缺氧(血紅蛋白降低、心臟指數下降、低氧血癥、微循環障礙和堿中毒等),從而發生氧供需失衡。隨疾病發展、惡化,細胞線粒體發生結構及功能損害,氧化還原中氫活化和電子傳遞系統受抑制;使NAD+(煙酰胺腺嘌呤二核苷酸)不能再生,導致依賴 NAD+/NADH的代謝過程不能正常運轉。此外,由此導致的乙酰輔酶 A和草酰乙酸生成不足,障礙瞭脂肪及蛋白質代謝進入三羧酸循環氧化產能。上述代謝改變以肝臟最為明顯,肝內氨基酸代謝障礙。機體隻能利用在肝外代謝的支鏈氨基酸代謝產能,導致氨基酸譜變化及蛋白合成障礙。
⑤ 纖維連接蛋白(FN)消耗過多或產生不足:FN是由成纖維細胞、血管內皮細胞、巨噬細胞及肝庫普弗氏細胞合成的。它是一種糖蛋白。分血漿型和組織型兩種。血漿型FN在血液中主要起調理作用,能與血流中的異物顆粒(如變性膠原、纖維蛋白微凝集物、受損組織碎屑、聚集的血小板、破壞的血細胞及細菌等)結合形成復合體,使其易於被網狀內皮系統細胞識別及吞噬。組織FN是血漿型FN的前體,起細胞與細胞、細胞與結締組織連接的作用。一旦血漿型FN被消耗過多,組織型FN即釋出,結果導致細胞連接松散,血管通透性增加。機體吞噬能力下降,可使感染加重、DIC進一步惡化。
⑥ 免疫功能損害:研究表明,敗血癥性MSOF患者細胞免疫及體液免疫功能均降低。
癥征及診斷標準 主要為原發病和各系統臟器功能衰竭表現。早期癥狀常被原發病掩蓋,故對MSOF高危患者應進行嚴密監護。
治療 可包括以下七個方面。
① 去祛病因是治療的關鍵。凡原發病未能去除或有效控制者,預後均極差,尤以嚴重感染及大塊組織壞死者更為明顯。
② 清除或拮抗內毒素:研究證實患革蘭氏陰性桿菌敗血癥後,未用抗生素時血漿中遊離內毒素濃度大致與細菌數量成比例。而用抗生素後血流中細菌減少而內毒素濃度卻升高。清除內毒素的措施有中藥(多種清熱解毒和活血化瘀中藥,如金銀花、蒲公英、大青葉、魚腥草、穿心蓮、元參等);內毒素抗血清(1977年首先采用大腸桿菌免疫血清,臨床試用有效,目前單克隆抗體已生產)。
③ 拮抗腫瘤壞死因子(可中和腫瘤壞死因子的毒性,阻斷其誘導的MHC-Ⅰ類抗原的表達。試用於嚴重的膿毒性休克,取得一定效果)。
④ 阻止Ca2+進入細胞(多種Ca2+通道阻滯劑均可防止或減輕缺血、缺氧導致的組織損害;目前應用的較多的是異搏定和硝苯呲啶,中藥丹參亦具有此作用)。
⑤ 清除或拮抗氧自由基及脂質自由基:可用別嘌呤醇、維生素E和維生素C(別嘌呤醇可抑制黃嘌呤氧化酶,從而抑制氧自由基的形成;維生素 E是強力自由基清除劑,一個α-生育酚分子可以清除2個自由基;維生素C可在細胞內外發揮作用,並可使 α-生育酚自由基恢復原型)、清除氧自由基的酶類(包括SOD、CAT和GSH-PX)、其他藥物及中藥(葡萄糖、甘露醇、含硫氨基酸如蛋氨酸、半胱氨酸、不飽和脂肪酸、輔酶Q10、氯丙嗪和去鐵胺等;去鐵胺通過與鐵螯合成絡合物,降低血清鐵離子,從而減少·OH的形成。中藥當歸、女貞子、茜草、山楂及燈盞花等均已證明具有此種作用)。
⑥ 針對血栓素合成的藥物:小劑量水楊酸可使環氧合酶乙酰化,從而抑制血栓素的形成。硝酸甘油可增加血管壁內皮細胞合成前列環素(PGI2,具有拮抗血栓素的效應)。潘生丁可能促進前列環素合成和抑制血栓素。654-2 靜滴有增加血漿前列環素的作用。
⑦ 支持及對癥治療。
參考書目
D.E.Fry,Multiple System Organ Failure.Surg.Clin.North Am.,68:107,1988.