化學式CO。無色、無臭、無味、劇毒的可燃性氣體。各種含碳的燃料在供氧不足、燃燒不充分、未完全轉化為二氧化碳時,排出的廢氣中含有大量的CO。例如從各種燃燒爐和內燃機排出的廢氣中常含有2%~10%的CO。工業區和汽車多的街道的空氣中也會含有少量的CO。
在常壓下CO可以在−191.5℃液化,在−205℃凝固。密度1.25克/升(室溫)。在水中的溶解度很小,100體積的水隻能溶解2.3體積的CO(20℃),但易溶於乙醇、氨水和和鹽酸中。
化學性質 CO分子是不飽和的亞穩態分子。不易分解,但容易被催化劑激活,在高溫、高壓下具有很高的化學活性,能發生很多種化學反應。
燃燒生成二氧化碳並放出67.7千卡/摩的熱量。在室溫下和有二氧化錳及氧化銅混合物存在時,可以被催化氧化為二氧化碳,因此MnO2–CuO混合物可用制作防毒面具。CO是還原劑,在CO氣氛中加熱許多金屬氧化物(如Cu、Fe、Co、Ni、Pb、Mo、Ag、Sn等的氧化物),可以把它們還原為相應的金屬。CO和過渡金屬反應,可以生成金屬羰基化物,例如在100~200℃和5~20兆帕下,CO和鐵反應生成羰基鐵Fe(CO)5。在50~100℃和常壓下,CO和鎳反應生成羰基鎳Ni(CO)4。羰基鎳是穩定的液體,加熱時揮發,180℃又熱分解為鎳和CO,是實驗室制備高純鎳粉和CO的方法。羰基金屬可用作有機合成反應的試劑和催化劑。
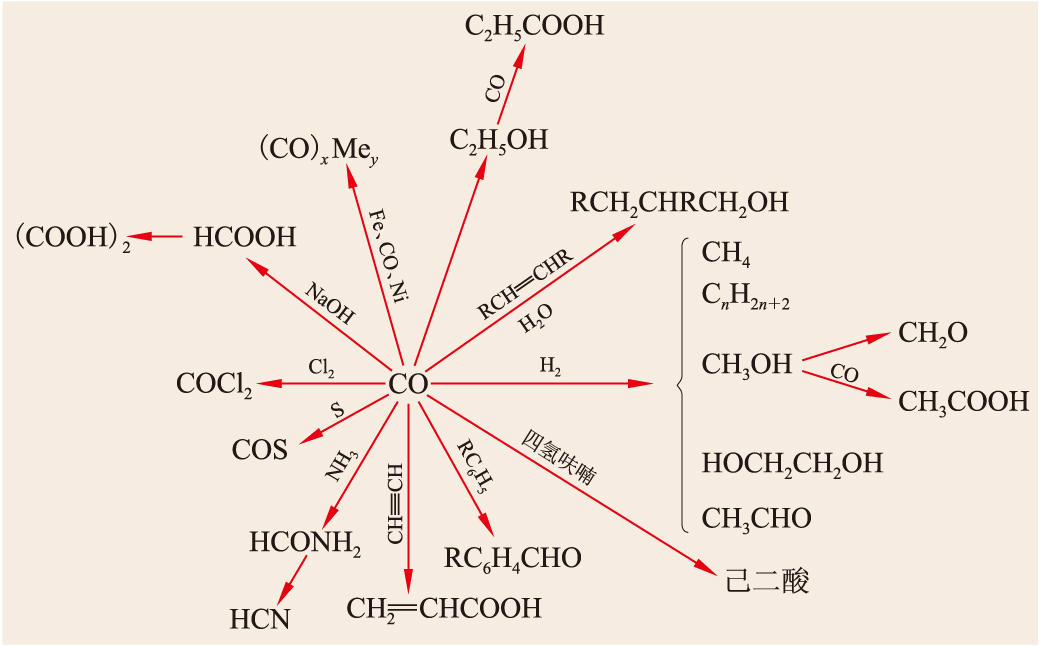 一氧化碳的各種化學反應
一氧化碳的各種化學反應
CO和氯Cl2在230℃和活性炭的催化下,反應生成光氣COCl2。
CO與氨NH3反應,生成甲酰胺HCONH2,甲酰胺脫水生成氰化氫HCN。
CO和H2在各種不同的催化劑作用下,可以反應合成多種有機化合物,例如甲醇、乙二醇、烴類等。費托合成就是選用加堿的鐵或鈷作催化劑,在190~350℃和0.7~20兆帕的條件下,使H2和CO的混合氣反應合成為含低碳原子的直鏈烷烴和烯烴,這是一種將煤先制成水煤氣(約含44%CO和45%H2)再轉化為液體燃料的工業方法。選用銅–鋅–鉻為催化劑,在230~270℃和5~10兆帕條件下,摩爾比為3的H2和CO可以反應合成甲醇:
CO+2H 2朳 CH 3OH Δ H=−90.79kJ/ mol用羰基銠作催化劑,在190~240℃和15~20兆帕條件下,摩爾比為1的H2和CO反應合成乙二醇HO—CH2—CH2—OH。
CO可與醇、不飽和脂肪烴或芳烴在一定條件下反應,合成得到醇、羧酸、酯、醛等產物。例如工業上制備乙酸CH3COOH就是利用催化劑在加熱和加壓的情況下,使CO與甲醇反應。若用NaOH作為催化劑,則CO與甲醇反應,生成甲酸甲酯HCOOCH3。在有氧參與反應的情況下,CO與甲醇反應,生成草酸二甲酯CH3OOC—COOCH3。在有氫參與反應時,CO與甲醇反應則生成高一級的乙醇;與不飽和烯烴反應生成醛RCH2—CH2—CHO。在有水蒸氣參與反應時,CO與不飽和烯烴H2C═CH2或炔烴HC≡CH反應,分別生成CH3CH2COOH(丙酸)或CH2═CHCOOH(丙烯酸)。
CO的各種化學反應見圖。
制法 實驗室中用甲酸加到濃硫酸裡可以制備少量的高純CO。工業上可以采用固體燃料氣化法、水煤氣法(含約50%CO)、發生爐煤氣法(含22%~26%CO)等。水煤氣是用水蒸氣作用於燃燒熾熱的煤或焦炭上生成的CO和H2的混合氣:
C+H 2O朳 CO+H 2CO+H 2O朳 CO 2+H 2也可以用天然氣(主要成分甲烷)在催化劑作用下與水蒸氣反應生產CO。
應用 CO作為各類合成氣和煤氣中的主要組分,是合成有機化工產品或化工中間體的重要原料,可用於制備幾乎所有的基礎化學品,如氰化氫、光氣、醇、羧酸、酯、醛、醚、烴。CO和過渡金屬生成的羰基金屬是重要有機合成的均相催化劑。利用羰基金屬的熱分解,可以制得高純金屬以及金屬膜。
毒性 一氧化碳有劇毒,因為它比氧更容易和血紅蛋白結合,可以把氧從氧合血紅蛋白中置換出來,生成碳氧血紅蛋白,從而破壞瞭生物體組織中氧的循環和交換,並導致組織缺氧,特別是使中樞神經系統細胞缺氧。缺氧的程度決定於吸入CO的濃度和時間。CO通過呼吸器官侵入人體,由於它無臭不易被人察覺,危害特別大。在工廠車間裡CO的濃度不得大於0.03毫克/升,人在CO濃度為0.2毫克/升的房間裡不得連續呆上15~20分鐘。對CO中毒的救護必須迅速及時,首先將患者移至通風良好的地方,進行人工呼吸或吸氧,搶救及時,康復後一般不會留後遺癥。見一氧化碳中毒。