元素符號Ba,銀白色金屬,在元素週期表中屬ⅡA族,原子序數56,原子量137.33,體心立方晶體,常見化合價為+2。
18世紀時,人們常把不溶於水的固體氧化物籠統地稱為“土”,例如陶土、稀土;1774年瑞典化學傢舍勒(C.W.Scheele)發現氧化鋇是一種比重大的新土,稱之為“Baryta”(重土)。1808年英國化學傢大衛(H.Davy)用汞作陰極,鉑作陽極,電解重晶石(BaSO<4)制得鋇汞齊,經蒸餾去汞後,得到一種純度不高的金屬,並以希臘文barys(重)命名。自然界鋇的主要礦物為重晶石(BaSO4)和毒重石(BaCO3)。重晶石礦床分佈很廣,中國的湖南、廣西、山東等地都有較大的礦床。
性質和用途 鋇的化學性質十分活潑,在室溫下與氧和鹵素猛烈反應,並放出大量的熱。與水反應激烈,放出氫氣。溫度升高後,可與氫生成氫化鋇(BaH2),與氮生成氮化鋇(Ba3N2),與碳生成碳化鋇(BaC2)。鋇的還原性很強,它可以還原大多數金屬的氧化物、鹵化物、硫化物而得到相應的金屬。
鋇的主要物理性質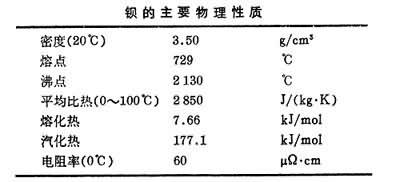
金屬鋇的主要用途是作消氣劑,以除去真空管和電視顯象管內的痕量氣體。在蓄電池極板的鉛合金中加入少量的鋇,能改善性能。鋇也可作球化劑和脫氣合金,用於制造球墨鑄鐵和精煉金屬。鋇的化合物用途廣泛,重晶石可作鉆探用的泥漿。鋅鋇白(BaSO4、ZnS和 ZnO的混合物)俗稱立德粉,是一種常用的白色顏料。鈦酸鋇(BaTiO3)壓電陶瓷廣泛用作儀器中的換能器。鋇鹽(如硝酸鋇)燃燒時,呈明亮的綠黃色,大量用於制造焰火和信號彈。硫酸鋇常用於醫學上X射線腸胃診察,俗稱“鋇餐造影”。
金屬鋇用充氬氣的塑料袋包裝後,再裝入充氬氣的鐵桶內密封保存。鋇經真空蒸餾可制得高純鋇。目前世界上金屬鋇年產量約數噸。1978年美國市場鋇價格為17~33美元/公斤。
生產工藝 工業上制取金屬鋇分為制取氧化鋇和金屬熱還原(鋁熱還原)兩個步驟。
氧化鋇的制取 采用優質重晶石礦,或經手選和浮選,除去鐵和矽後,得到含硫酸鋇(BaSO4)大於96%的精礦。將粒度小於20目的礦粉與煤或石油焦粉按重量比4:1混合,在反射爐內於1100℃下焙燒,硫酸鋇被還原成硫化鋇(BaS),俗稱“黑灰”。用熱水浸出得到BaS溶液。向BaS水溶液中加入碳酸鈉或通入二氧化碳,使硫化鋇轉化成碳酸鋇(BaCO3)沉淀。將BaCO3與炭粉混合後,於800℃以上煅燒,制得氧化鋇(BaO)。BaO能在500~700℃氧化生成過氧化鋇(BaO2),700~800℃時BaO2又分解生成BaO;因而要求煅燒產物在惰性氣體保護下冷卻或淬冷,以免生成BaO2。
鋁熱還原法生產金屬鋇 因配料比不同,鋁還原氧化鋇的反應可能有兩種,反應式為:
6BaO+2Al─→3BaO·Al2O3+3Ba↑
或
4BaO+2Al─→BaO·Al2O3+3Ba↑
這兩種反應在1000~1200℃時,都隻能生成少量的鋇,因此,必須用真空泵將鋇蒸氣不斷地從反應區轉移到冷凝區,反應才能不斷向右進行。反應後的殘渣有毒,需經處理才能棄去。
鋇毒 溶於水和酸的鋇鹽都有劇毒。急性中毒的主要癥狀是眩暈、流涎、嘔吐、腹痛、腹瀉、心律紊亂、驚厥、麻痹以至死亡。在處理鋇和鋇鹽時,要加強操作人員的安全防護措施。所有廢棄物均應用硫酸亞鐵或硫酸鈉進行處理,使有毒的鋇鹽轉化成溶解度小的硫酸鋇。
參考書目
J.C.Bailar et al.,Comprehensive Inorganic Chemistry,Vol.I,Barium,Pergamon,Oxford,1973.