將微小物體或物體的微細部分高倍放大,以便觀察的儀器或設備。它廣泛應用於工農業生產及科學研究。生物學和醫學工作者在業務中也經常使用顯微鏡。大致分為光學顯微鏡和電子顯微鏡。
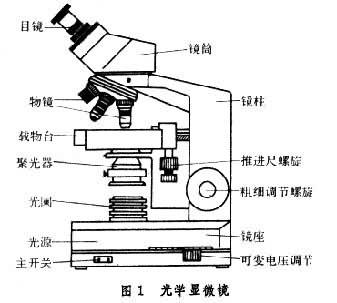
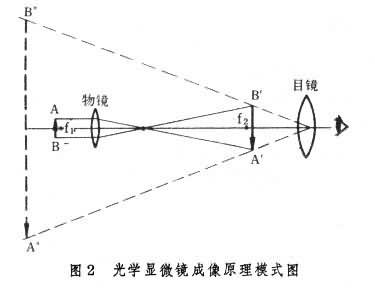
光學顯微鏡 即以可見光為光源的顯微鏡。普通的光學顯微鏡在結構上可分為光學系統和機械裝置兩個部分。光學系統主要包括目鏡、物鏡、聚光器、光闌及光源等部分。機械裝置主要包括鏡筒、鏡柱、載物臺、鏡座、粗細調節螺旋等等部分(圖1)。其基本光學原理如圖2,圖中左邊小的凸透鏡代表短焦距的一組透鏡,稱物鏡。右邊大的凸透鏡代表長焦距的一組透鏡,稱目鏡。被觀察的物體(AB)放在物鏡焦點(f1)稍外的地方。物體的光線通過物鏡後在目鏡焦點(f2)稍內方形成一個倒立的放大實像(B'A')。觀察者的眼睛通過目鏡將該實像(B'A')進一步放大為一個倒立的虛像(B″A″)。
目鏡位於顯微鏡筒的上方,一般由兩個凸透鏡構成。它除瞭進一步擴大物鏡所形成的實像之外,也限制瞭眼睛所觀察的視野。按放大率分,常用目鏡有5倍、10倍和15倍三種。
物鏡一般位於顯微鏡筒的下方,接近所觀察的物體。由8~10片透鏡組成。其作用一是放大(給物體造成一個放大的實像),二是保證像的質量,三是提高分辨率。常用物鏡可按放大率分為低倍 (4×)、中倍(10×或20×)、高倍 (40×)和油浸物鏡(100×)。多個物鏡共同鑲在換鏡轉盤上,可以按需要轉動轉盤選擇不同倍數的物鏡。
顯微鏡的放大倍數為目鏡倍數乘物鏡倍數,如目鏡為10倍,物鏡為40倍,則放大倍數為40×10倍(放大400倍)。優良的顯微鏡可放大2000倍,可分辨相距1×10-5cm的兩點。
當白光通過凸透鏡時,波長較短的光(藍紫色),其折射度大於長波長的光(紅橙色),因此,成像時在像周出現各色光譜圍繞,並且有一圈藍色或紅色的輝光,這種顏色上的缺陷稱為色差。由於光線進入(和離開)透鏡鏡面各部分的角度不同,從透鏡四周透過的光線與從透鏡中心透過的光線相比,其折射角度較大。因此,成像時在像周出現模糊而歪曲的影像。這種成像面彎曲的缺陷稱為球面差。一系列形狀、結構和距離不同的凸和凹透鏡組互相配合,便能最大限度地糾正色差和球面差,形成一個明亮、清晰而準確的影像。這就是目鏡或物鏡分別由一組透鏡構成的緣故。這種透鏡稱為平場消色差透鏡。
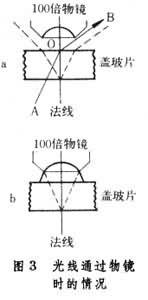
光線從一種介質(如空氣)投射到另一種較為致密的介質(如玻璃)中時會彎向“法線”(與介質交界面垂直的一條線),如圖3中的BOA線。光線由致密介質(玻璃)進到不致密介質(空氣)中時會偏離“法線”,如AOB線(圖3a)。當光線穿過聚光鏡玻璃(折射率為1.51)進入空氣時同樣會偏離,向外折射,因此進入物鏡的光量減少很多,像的分辨力也降低。使用100倍物鏡時,如果在物鏡和蓋玻片之間充以油液(折射率同樣為1.51)以隔絕空氣,則光線幾乎可以不折射地進入物鏡,這就增加瞭像的亮度和分辨率。這種物鏡稱為油浸物鏡(圖3b)。
聚光器位於顯微鏡臺的下方,可會聚來目光源的光線,將光量集中於標本,使標本受到光強適度的均勻照射。聚光器的下端裝有孔徑光闌(光圈)以控制光束的粗細。
普通光學顯微鏡的照明光源位於聚光器的下方,為特制的照度均勻的強光燈泡,並且配有可變電阻,可以改變光線的強度。
由於普通光學顯微鏡的光源光線自鏡體下方向上透射,通過聚光鏡、物鏡,達到目鏡,因此在醫學及生物學研究中必須將被觀察的樣品切成能透過光線的、厚約6μm 的薄片,並且要進行染色以顯示不同的組織和細胞等細微結構。整個加工過程稱常規組織制片技術,包括選取適當的組織材料經甲醛(福爾馬林)液固定,逐級酒精脫水,石蠟包埋,用切片機將組織切成薄片裱在玻璃片上,再經蘇木素—伊紅染料著色,最後將組織玻片封固在光學樹脂膠內。制好的組織玻片可長期保存。
顯微鏡的目鏡和物鏡安裝在鏡筒的兩端,它們的距離是固定的。將組織玻片放在載物臺上,旋轉粗調螺旋使載物臺接近物鏡。組織切片進入物鏡第一焦平面,目鏡內即可見標本內的組織影像。然後用細調螺旋使目鏡內的影像清晰即可進行觀察。改換放大倍數時就要調換目鏡或物鏡。
醫學和生物學常使用的光學顯微鏡 有下列12種:
暗視野顯微鏡 在普通光學顯微鏡臺下配一個暗視野聚光器(圖4),來自下面光源的光線被拋物面聚光器反射,形成瞭橫過顯微鏡視野而不進入物鏡的強烈光束。因此視野是暗的,視野中直徑大於0.3μm的微粒將光線散射,其大小和形態可清楚看到。甚至可看到普通明視野顯微鏡中看不見的幾個毫微米的微粒。因此在某些細菌、細胞等活體檢查中常常使用。
實體顯微鏡 由雙筒目鏡和物鏡構成。放大率7~80倍。利用側上方或下方顯微鏡燈照明。在目鏡內形成一個直立的放大實像,可以觀察未經加工的物體的立體形狀、顏色及表面微細結構,並能進行顯微解剖操作,也可以觀察生物機體的組織切片。
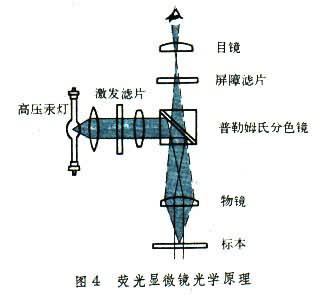
熒光顯微鏡 在短波長光波(紫外光或紫藍色光,波長250~400nm)照射下,某些物質吸收光能,受到激發並釋放出一種能量降級的較長的光波(藍、綠、黃或紅光,波長400~800nm),這種光稱熒光。某種物質在短光波照射下即可發生熒光,如組織內大部分脂質和蛋白質經照射均可發出淡藍色熒光,稱為自發性熒光。但大部分物質需要用熒光染料(如吖啶橙、異硫氰酸熒光素等)染色後,在短光波照射下才能發出熒光。熒光顯微鏡的光源為高壓汞燈,發出的紫外光源經過激發濾光片(此濾光片可通過對標本中熒光物質合宜的激發光)過濾後射向普勒姆氏分色鏡。分色鏡將激發光向下反射,通過物鏡投射向經熒光染料染色的標本。染料被激發並釋放出熒光,通過物鏡,穿過分色鏡和目鏡即可進行觀察。目鏡下方安置有屏障濾片(隻允許特定波長的熒光通過)以保護眼眼及降低視野暗度(圖4)。熒光顯微鏡的特點是靈敏度高,在暗視野中低濃度熒光染色即可顯示出標本內樣品的存在,其對比約為可見光顯微鏡的100倍。30年代熒光染色即已用於細菌、黴菌等微生物及細胞、纖維等的形態觀察和研究。如用抗酸菌熒光染色法可幫助在痰中找到結核桿菌。40年代創造瞭熒光染料標記蛋白質的技術,這種技術現已廣泛應用於免疫熒光抗體染色的常規技術中,可檢查和定位病毒、細菌、黴菌、原蟲、寄生蟲及動物和人的組織抗原與抗體,可用以探討病因及發病機理,如腎小球疾病的分類及診斷,乳頭瘤病毒與子宮頸癌的關系等。在醫學實驗研究及疾病診斷方面的用途日益廣泛。
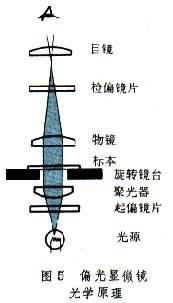
偏光顯微鏡 從光源發出的光線通過空氣和普通玻璃時,在與光線垂直的平面內的各個方向以同一振幅進行振動並迅速向前方傳遞,這是光的波動性原理。空氣與普通玻璃為各向同性體,又稱單折射體。如果該光源的光通過一種各向異性體(又稱雙折射體)時,會將一束光線分為各隻有一個振動平面的,而且振動方向互相垂直的兩束光線。這兩束光線的振動方向、速度、折光率和波長都不相同。這樣隻有一個振動平面的光線稱偏振光。偏光顯微鏡即利用這一現象而設計。偏光顯微鏡內,在物鏡與目鏡間插入一個檢偏鏡片,光源與聚光器間鑲有起偏鏡片,圓形載物臺可以作360°旋轉(圖5)。起偏與檢偏鏡片處於正交檢偏位時,視野完全變黑。將被檢物體放在顯微鏡臺上。若被檢物為單折射體,則旋轉鏡臺,視野始終黑暗。若旋轉鏡臺一周,視野內被檢物四明四暗,則說明被檢物是雙折射體。許多結晶物質(如痛風結節中的尿酸鹽結晶、尿結石、膽結石等),人體組織內的彈力纖維、膠原纖維、染色體和淀粉樣原纖維等都是雙折射體,可借偏振光顯微鏡術檢驗,進行定性和定量分析。
位相顯微鏡 又稱相差顯微鏡或相襯顯微鏡。普通光學顯微鏡之所以看不見未染色的組織、細胞和細菌、病毒等活機體的圖像,是因為通過樣品的光線變化差別(反差)很小。標本染色後改變瞭振幅(亮度)和波長(顏色),影響瞭反差而獲得圖像。但是染色會引起樣品變形,也可使有生命的機體死亡。要觀察不染色的新鮮組織、細胞或其他微小活體必須使用位相顯微鏡。位相顯微鏡的原理是兩個光波因位相差而互相幹涉,出現光波強弱和反差的改變而成可見影像。點光源發出的光線可以表現為正弦波圖形(圖6a)。兩個波峰間的距離為波長,波的振幅表示光的亮度(振幅大、亮度高)。設想同一光源發出的兩條光波,分別同時通過空氣及某種透明介質。在通過一定厚度的某種透明介質時,光波的速度就會降低,但是光的亮度未變。光波在通過該透明介質後比一直在空氣中前進的另一條光波遲滯瞭波長,因而兩條光波出現瞭位相的變化(位相差)。但人眼不能分辨這兩條平行光線的位相差。如果這兩條光波射到光屏的同一點上,而且一條光波比另一條光波遲滯瞭半個波長,即兩條光波因位相相反而互相幹涉抵消則光線消失,或者相對振幅相互影響而光線減弱。如果一條光波雖然遲滯瞭一個波長,但兩條光波位相相同,則因波的疊加而光線增強。
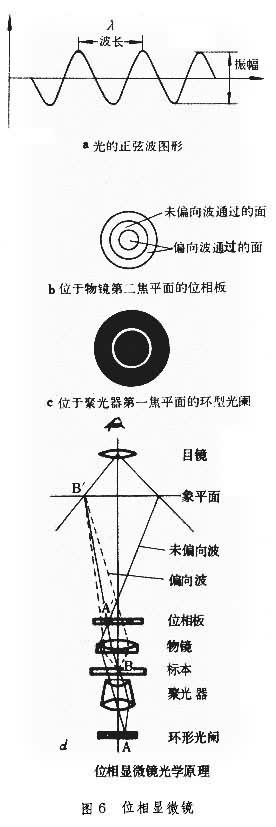
位相顯微鏡的基本結構與普通光學顯微鏡相同。不同之處在於:①物鏡鏡頭上面,在物鏡第二焦平面裝有一塊圓盤狀的位相板(圖6b)。②聚光器下面,在聚光器第一焦平面裝有環形光束,光束上刻有狹窄的縫隙可通過環形強光(圖6c)。如圖6d所示,環形光束 A點發出的光線經過聚光器後成為平行光線。光線通過載物臺上的樣品時,因樣品內各個質點(如b點)的折射率不同而受到幹涉,發生衍射,即分為未偏向波(實線)和偏向波(虛線)。未偏向波通過物鏡聚焦於位相板 A' 點上成像,然後通過位相板,均勻地分佈在標本像平面上成為背景。偏向波通過物鏡後從位相板 A'點周圍通過位相板同樣聚焦在像平面的B'上。換句話說,未偏向波和偏向波是分別通過位相板的不同部位。在位相板上不同的區域塗有不同的塗層,可以分別改變未偏向波或偏向波的速度和亮度,由此兩種光波出現瞭位相差,差瞭半個波長或一個波長,它們在像平面的合波就出現明暗對比,樣品內的各個細節也就能看得見。
總之,位相顯微鏡是利用樣品中質點折射率的不同或質點厚度的不等,產生光線的相位差,使新鮮標本不必染色就可以看到,而且能夠觀察到活細胞內線粒體及染色體等精細結構,還可以應用於黴菌、細菌、病毒等更微小活體的研究,進行標本形態、數量、活動及分裂、繁殖等生物學行為觀察,並可進行量度與比較。
倒置式顯微鏡 普通顯微鏡鏡的物鏡頭方向向下接近標本。倒置式顯微鏡的物鏡鏡頭則處於垂直向上的位置,因此目鏡和鏡筒的縱軸與物鏡的縱軸呈45度角。載物臺面積較大,在物鏡上方,載物臺上方有一個長焦距聚光器和照明光源。物鏡和聚光器可裝配位相顯微鏡的附件。放大率16~80倍。組織培養瓶和培養皿可以直接放在載物臺上,進行不染色新鮮標本及活體、細胞的形態、數量和動態觀察。可進行多孔微量生物化學及免疫反應平板的結果觀察。倒置式顯微鏡可換用普通亮視野光學鏡頭;可裝配偏振光、微分幹涉差、熒光附件進行觀察。
微分幹涉差顯微鏡(DIC) 又稱幹擾或幹涉顯微鏡。能看到和測定微小的位相變化,與位相顯微鏡相似,使無色透明的標本具有明暗和顏色的變化,從而增強反差。在普通光學顯微鏡的基本結構上安裝偏光和幹涉部件,以及360°旋轉載物臺。它又利用偏振光的幹涉原理。如圖7所示,在光源上方安置有起偏鏡片和光束分解棱鏡。從起偏鏡片出來的直線偏振光通過光束分解棱鏡後,分成互相垂直振動的兩條直線偏振光。兩條光線經聚光器折射後射向樣品。因樣品內各個質點的折射射率不同,部分光波的位相改變及因幹涉而發生橫向偏移。兩條光線通過物鏡後經第二組光束分解棱鏡相合並,由檢偏鏡發生幹涉。終末像的每一個點是由物體上同一點的兩個互相重疊的不同圖像構成的一種混合像,從而使肉眼得以辨識。
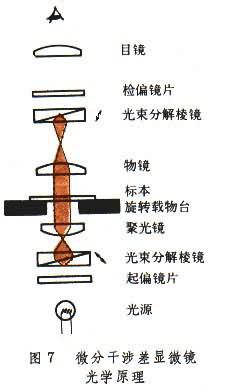
微分幹涉差顯微鏡同樣可以觀察到在普通亮視野中看不見的無色透明物體,可以觀察細胞、細菌等活體,而且影像呈立體感,較位相顯微鏡的影像更細致、更逼真。可用它對活細胞的各個部位作更精細的研究。如果用白光照明,不同位相表現為各種顏色,轉動載物臺,顏色會發生變化。單色光照明產生明暗反差,各種成分呈現不同的對比度。微分幹涉差顯微鏡又可以作為一種高度精密的超微量光學天平來使用,用以估測的幹物體的精確質量可以小到1×-14克。當細胞中所含固體物質的濃度增加百分之一時,其折射率相應增加0.0018。細胞各相成分的折射率可以根據它與相關區域(懸浮液區)間位種的不同而估計,從而可進一步算出一個細胞中某些成分的幹燥重量。
攝影顯微鏡 現代高質量顯微鏡均可安裝顯微照相的各種附件,可以及時完整地保留科學資料。用於照相的顯微鏡要求光學系統和機件結構精密,鏡體堅固穩定。它裝配三目鏡筒,其中兩個45°角觀察用目鏡鏡筒和一個中央垂直鏡筒安裝135照相機、曝光測量附件、照相目鏡及取景鏡頭,可以進行取景和調焦。聚光器能調節視場中心並配有孔徑光闌使視場照明均勻。鏡座有可調節視場光闌,有電壓表和電壓顯示燈。有可變電阻調節照明亮度。照明光源為6~12伏40~100瓦鹵素燈泡。80年代的自動曝光顯微照相裝置具有自動卷片,自動測光、自動控制曝光,測量和調整色溫以及倒易律失效的補償等各項功能,均用電子計算機自動控制,可以進行黑白感光片、彩色負片和彩色幻燈片的投照。
中央垂直鏡筒又可以安裝電視攝像裝置或16mm電影攝影機及控制裝置,可對活體標本進行定時定格或連續的攝影記錄。
萬能研究用攝影顯微鏡系統 集普通亮視野、暗視野、偏振光、熒光、位相、微分幹涉差、顯微攝影等各項功能於一個系統中。還有電子計算機控制的低倍攝影自動聚焦、自動轉換物鏡、聚光器自動匹配、自動調整光源亮度等功能。機身安裝兩個135照相機,一個4×5英寸大版照相機。可另外安裝電視攝像和16mm電影攝影裝置,同樣具有自動卷片、自動測光、自動控制曝光、測量和調節色溫、倒易體失效補償等多項功能。
電子顯微鏡 光學顯微鏡的分辨本領由於所用光波的波長而受到限制。小於光波波長的物體因衍射而不能成像。最高級的光學顯微鏡的分辨本領的限度約200nm(2000Å)。為瞭突破這一限度,可采用電子射線來代替光波。電子微粒以高速運動時,其行為類似光波的傳播過程。運動電子的波長隨其速度而定,在增壓達50萬伏時,其波長為0.001nm(0.01Å),即電子射線的波長約為可見光的十萬分之一,其分辨本領的極限約為4Å,其放大倍數比最高級的光學顯微鏡要高很多級。以電子射線為電子光源的顯微鏡稱為電子顯微鏡。現代醫學和生物學使用的電鏡分辨率為5~10Å,即放大率為10~20萬倍。
由於標本厚薄不同,超薄切片機切出的很薄的標本,可用透射式電子顯微鏡觀察。不能切得很薄的標本可用掃描式電鏡進行觀察。
透射式電子顯微鏡(TEM) 是最常用的電子顯微鏡,由電子槍、電磁透鏡系統、熒光屏(或照相機)、鏡筒、鏡座、變壓器、穩壓裝置、高壓電纜、真空泵系統、操縱臺等部分組成。電子槍相當於光學顯微鏡中的光源,供應和加速從陰極熱鎢絲發射出來的電子束。電鏡所用的電壓一般在20~30萬伏特,才足以使電子槍裡的電子以高速飛出。電子通過聚光透鏡,達到標本上,因為標本很薄,高速電子可以透過,並且由於標本各部分的厚度或密度不同,通過的電子就有疏密之分。電壓需要嚴格穩定才能使成像穩定,很小的電壓改變就會引起嚴重幹擾。像的亮度可以通過電子槍來控制。
電磁透鏡組相當於光鏡中的聚光器、物鏡及目鏡系統。電子束通過各個電磁透鏡的圓形磁場的中心時可被會聚而產生像。電鏡的透鏡系統由4組電磁透鏡組成,包括聚光透鏡、物鏡、中間透鏡和投射透鏡(目鏡)。可改變聚光透鏡的電流使電子束對標本聚焦並提供“照明”。物鏡靠近標本的焦點上。通過物鏡、中間鏡和投射鏡的三級放大,能在一定的距離處得到高倍的放大像,最終形成的像投射到熒光屏上。在熒光屏部位可換用黑白膠片以制取相片底板。改變電磁線圈中的電流量從而使電磁透鏡調焦,並產生不同的放大率(圖8)。

為瞭盡量減少電鏡中電子與空氣分子相碰撞而產生散射的機會,鏡筒中的真空度要求很高,因此密封的鏡筒與真空泵相連。由於標本需置於真空的鏡筒內,因此不能檢查活材料。
光鏡主要利用可見光波作為光源,樣品染色後改變瞭光的波長(顏色)和振幅(亮度),影響瞭反差從而得到圖像。電鏡使用電子射線。電子束的穿透力不強,所以供電鏡檢查的標本必須切到薄至50~100nm厚度的切片。電鏡切片的制作步驟與光鏡切片類似,也是由固定、脫水、包埋、切片和染色等程序組成:首先從欲觀察的標本上取材,體積約1mm3。通過戊二醛和四氧化鋨雙固定後,逐級酒精(或丙酮)脫水,環氧樹脂包埋,超薄切片機切片。在電鏡中像的形成是組織片各個部分對電子束的電子產生不同散射的結果,標本中致密的地方(細節)散射強。可使用各種重金屬鹽染色以增加反差,常用的是醋酸鈾和枸櫞酸鉛復染。由於電子束穿不透玻璃,染好的薄膜切片放在小銅網格上作電鏡觀察。
冷凍蝕刻技術是50年代發明、後來經過改進的一種新的電鏡標本加工技術。其主要原理是把液氮內快速超低溫(-200℃)冷凍的生物標本放在真空冷凍裝置裡斷裂,從而將不同部位的細胞器內部結構暴露出來,表現出高低不等的三維結構。在新形成的折斷面上噴鍍一層鉑金碳膜(復型)。將已鍍膜標本在強酸或強堿性腐蝕溶液裡消化,復型膜即漂浮、經打撈、清洗,放在小銅網上進行電鏡觀察和照相。冷凍蝕刻技術在細胞生物膜結構(如細胞膜、線粒體、內質網等)的研究上發揮瞭重大作用。
掃描式電子顯微鏡(SEM) 標本較厚的表面要產生一個電子光學圖像就要采用電子掃描法(圖9)。掃描電鏡的電子槍和電磁透鏡的結構原理類似透射電鏡。電子槍產生的大量電子通過三組電磁透鏡的連續會聚形成一條很細的電子射線(電子探針)。這條電子射線在電鏡筒內兩對偏轉線圈的作用下,順序在標本表面掃描。由於來自鋸齒波發生器的電流同時供應電鏡鏡筒內的和顯示管的兩組偏轉線圈,使得顯示器的電子射線在熒光屏上產生同步掃描。從標本上射出的電子經探測器收集,被視頻放大器放大並控制顯示管亮度。因此在熒光屏上掃描的亮度被標本表面相應點所產生的電子數量所控制,因而在熒光屏上顯示出標本的高倍放大像。通過控制兩套偏轉線圈的電流便可控制放大率的倍數。另外安裝有一個同樣的照相用同步掃描顯示管。
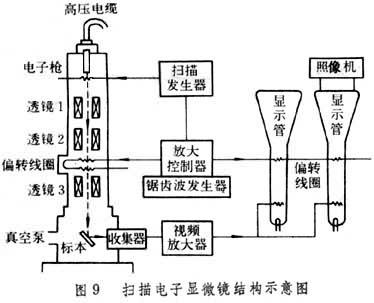
掃描電鏡標本制作中,既要脫水又要基本保持其自然狀態,因此使用標本的臨界冷凍幹燥技術:將組織表面清洗幹凈,經戊二醛和四氧化鋨雙重固定,逐級丙酮脫水。由於乙酸戊酯與液化Co2置換十分容易,因此首先用梯度乙酸戊酯置換丙酮。然後將標本放入密閉耐壓室內,導入液態Co2,使之浸沒標本。很快Co2將標本內乙酸戊酯完全置換出來,將後者排出耐壓室。同時耐壓室內的液態Co2與迅速蒸發的氣態Co2分子之間的互變達到動態平衡。使溫度逐漸上升,液態Co2蒸發加快而密度相應降低。達到Co2的臨界溫度31.1℃時,氣、液二相密度相同,二相的差異完全消失,即達到相的平衡,此時表面張力為零。使溫度繼續保持在稍高於臨界溫度的條件下,緩慢排出Co2氣體,當Co2排盡時,標本即已幹燥。取出幹燥好的標本,經真空噴鍍一層碳合金,或放入離子鍍膜機內鍍鉑和金,以增加標本的導電能力,加強反差和增強標本的穩定性。然後即可進行掃描電鏡觀察。
掃描電鏡具有分辨率高、景深長、視野廣、顯示三維立體結構、便於觀察和標本制備簡單等許多優點,在生物學及醫學上應用愈來愈多,用以觀察和研究生物標本的表現形態和內部立體結構。掃描電鏡的分辨本領已達到70Å的水平,已可以直接觀察脫氧核糖核酸(DNA)的分子結構。