分子因單鍵旋轉改變瞭其原子或原子團在空間的相對位置而呈現的不同立體形象。對構象的深入研究,大大促進瞭人們對許多複雜分子的物理、化學行為的理解。
構象可以使用紐曼投影式表示。一個分子即使隻沿某一個單鍵旋轉,也可以有無數個構象,但一般隻考慮某些有代表性的構象。例如丁烷分子,當沿C2—C3之間的單鍵旋轉時,由於連接在C2和C3上的各原子和各原子團相互間的作用,分子的能量呈圖1
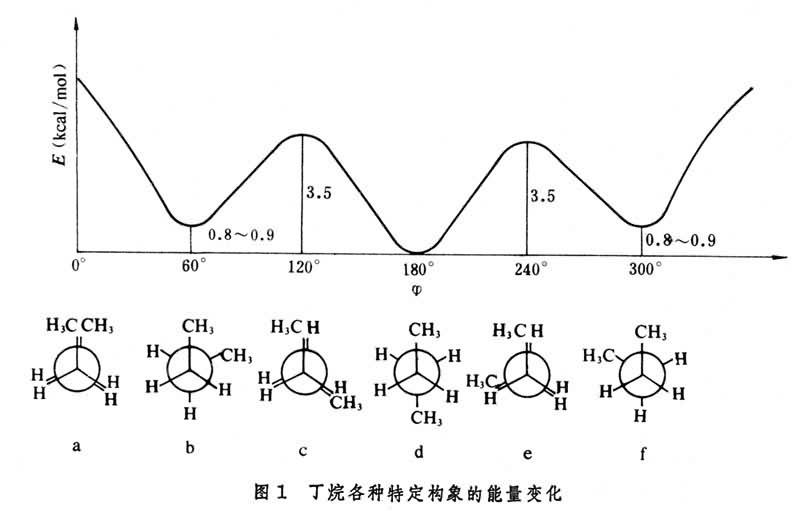 曲線所示的變化,並產生對應於曲線能峰和能谷的各種特定構象。以各式中兩個甲基的夾角為
φ,則根據國際純粹與應用化學聯合會命名法,
φ在30°以內的構象用sp表示,式a為
φ=0°和
φ=360°的特例,稱為全重疊構象;
φ在±60°以內的用sc表示,b、f為
φ=60°的特例,稱為鄰位交叉構象;
φ在±120°以內用ac表示,c、e為
φ=120°的特例,稱為部分重疊構象;
φ在±180°以內用ap表示,d是
φ=180°的特例,稱為對位交叉構象。其中最穩定的為式d,在室溫下70%以上的分子均以此構象存在。而式a則極少存在。溫度越低,處於穩定構象的分子的比例也越大。分子的任一構象的壽命均極短促,它們之間的能壘甚小,常溫下不能分離。
曲線所示的變化,並產生對應於曲線能峰和能谷的各種特定構象。以各式中兩個甲基的夾角為
φ,則根據國際純粹與應用化學聯合會命名法,
φ在30°以內的構象用sp表示,式a為
φ=0°和
φ=360°的特例,稱為全重疊構象;
φ在±60°以內的用sc表示,b、f為
φ=60°的特例,稱為鄰位交叉構象;
φ在±120°以內用ac表示,c、e為
φ=120°的特例,稱為部分重疊構象;
φ在±180°以內用ap表示,d是
φ=180°的特例,稱為對位交叉構象。其中最穩定的為式d,在室溫下70%以上的分子均以此構象存在。而式a則極少存在。溫度越低,處於穩定構象的分子的比例也越大。分子的任一構象的壽命均極短促,它們之間的能壘甚小,常溫下不能分離。
除環丙烷外,環烷烴的成環原子均不在同一平面內,為避免相鄰原子的重疊式構象存在,整個環系將傾向於取各構象中更為穩定的形式存在。環己烷有椅式、船式和扭船式等構象(見船式構象和椅式構象、圖2)。
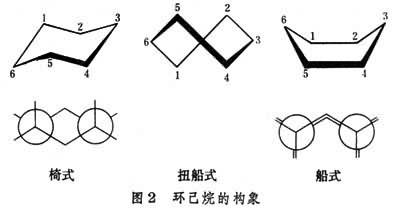 其中船式構象由於1、2、4、5四個碳原子處在同一平面,並兩兩成全重疊式,船頭和船尾3、6碳上兩個氫原子距離過近,位能最高。扭船式能量較其為低。而椅式由於所有的六個碳原子均兩兩成鄰位交叉式,能量最低,最為穩定。環庚烷的各種構象中以扭椅式最穩定,船式最不穩定。
其中船式構象由於1、2、4、5四個碳原子處在同一平面,並兩兩成全重疊式,船頭和船尾3、6碳上兩個氫原子距離過近,位能最高。扭船式能量較其為低。而椅式由於所有的六個碳原子均兩兩成鄰位交叉式,能量最低,最為穩定。環庚烷的各種構象中以扭椅式最穩定,船式最不穩定。